Del 1
Innledning
1 Om utvalget
1.1 Utvalgets mandat
Regjeringen Solberg oppnevnte 3. september 2021 et utvalg med oppgave å gjennomgå regelverk knyttet til apotekvirksomhet med sikte på å foreslå en fremtidsrettet regulering som legger til rette for økt konkurranse og nye apotekløsninger. Utvalgets mandat lyder slik:
Bakgrunn og formål
God tilgang til sikre og effektive legemidler av god kvalitet er viktig for befolkningens helsetjeneste. Legemidler og hele omsetningskjeden for legemidler, som legemiddelprodusenter, importører, grossister og apotek, er derfor underlagt omfattende regulering. Legemiddelpolitikkens målsetning fremkommer i Legemiddelmeldingen (Meld. St. 28 (2014–2015)). Den skal sikre god kvalitet ved behandling med legemidler, legemidler skal ha lavest mulig pris, det skal være likeverdig og rask tilgang til effektive legemidler, og det skal legges til rette for forskning og innovasjon. Apoteklovens formål er å sikre forsvarlig utlevering av legemidler til sluttbruker. Den skal bidra til riktig legemiddelbruk og sikre at alle deler av landet har tilgang til legemidler og farmasøytiske tjenester, som har god kvalitet og rimelig pris.
Dagens lov om apotek (lov 2. juni 2000 nr. 39 om apotek (apotekloven)) ble vedtatt 2. juni 2000 og iverksatt 1. mars 2001. Loven medførte store endringer i lovreguleringen av apotek, basert på forslag i NOU 1997: 6 Rammevilkår for omsetning av legemidler. Loven åpnet blant annet for at grossister kan eie apotek, med den følge at tre vertikalt integrerte apotekkjeder etablerte seg i Norge. Etter loven trådte i kraft har antall apotek mer enn doblet seg, fra 461 i 20011 til 1006 i juni 2021. Apotek bemannes av høyt kvalifisert personale. Legemiddelverket fant i 2020 at apotekdekningen fortsatt øker, at veksten i antall nye apotek er større enn markedsvekst målt i kroner, men at økonomien hos primærapotekene fortsatt vurderes som god.
Staten dekker nesten 80 pst. av utgiftene til reseptpliktige legemidler. Denne tredjepartsfinansieringen medfører at det ikke er sterk priskonkurranse mellom apotek ved salg av reseptpliktige legemidler til sluttbruker. For å nå målet om lavest mulig pris fastsetter derfor staten maksimalpriser på reseptpliktige legemidler til mennesker. Bruk av legemidler må i tillegg være i tråd med prinsippene for prioritering for at de skal få refusjon, og prisforhandlinger og refusjonskontrakter inngått mellom staten og legemidlets rettighetshaver medfører reduserte legemiddelpriser. Ved apotekloven ble det innført adgang for apotek til å bytte det legemidlet legen har rekvirert med et generisk likeverdig legemiddel hvis departementet har godkjent legemidlene som byttbare. Dette la til rette for innføring av trinnprismodellen i 2005 som reduserer prisene på generiske legemidler. Fra 1. juli 2021 kan det også fastsettes trinnpris for likeverdige og byttbare biologiske legemidler som har fått biotilsvarende konkurranse. Reseptfrie legemidler, legemidler til dyr og handelsvarer som selges i apotek er ikke prisregulert. Her dekker kunden kostnaden selv.
I Legemiddelmeldingen la regjeringen frem flere tiltak for å oppnå målet om riktig legemiddelbruk, herunder bruk av apotektjenester. Inhalasjonsveiledning og oppstartssamtale (Medisinstart) ble innført i henholdsvis 2016 og 2018 med offentlig finansiering. Andre tjenester som blodtrykksmåling, føflekkscanning og vaksinasjon tilbys i flere apotek, men må betales av den enkelte kunde. Høsten 2020 ble det åpnet for at farmasøyter i apotek kan rekvirere influensavaksine som administreres i apoteket, og i forbindelse med covid-19-pandemien er det åpnet for farmasøytrekvirering av vaksiner mot covid-19 i henhold til vaksinasjonsprogrammet. Enkelte kommuner har inngått avtaler med apotek om slik vaksinasjon.
I de senere år har det kommet ulike nye apotekformer, herunder nettapotek, apotek med salg via nettapotek og utlevering på fysisk apotek samt bruk av nettapotek i hjemmepleietjenesten (homecare apotek). Nye regler om salg av legemidler over internett i 2016 har åpnet for at salg av legemidler skjer via nettapotek. Etter nesten fem år er markedsandeler for nye apotekformer i Norge fremdeles moderat, noe som kan skyldes bl.a. vertikal integrasjon i markedet samt andre barrierer for etablering og konkurranse som følger av grossist- og apotekregelverket. Erfaringer med nettapotek i andre land indikerer at nettapotek kan stå for større andeler av legemiddelomsetningen. Samtidig vil teknologisk utvikling kunne åpne for andre apotekløsninger enn de som eksisterer i dag. NOU 1997: 6 som ligger til grunn for dagens regelverk ble lagt frem for 25 år siden. Utredningen var i det aller vesentligste innrettet mot datidens samfunn, og apotekloven stiller krav om at apotek skal være fysisk tilgjengelige. Loven ble derfor ikke gitt med tanke på å omfatte apotekløsninger som er mulig med den utviklingen av ny teknologi vi har i dag, som gir nye muligheter for distribusjon, samhandling og informasjonsutveksling mellom apotek, kunder og helsetjenesten.
Endringer i regelverket tilpasset nettapotek og økt bruk av teknologiske løsninger kan få konsekvenser for tilgangen til fysiske apotek og endre rammebetingelser for primær- og sykehusapotek samt nettapotek. Formålet med utvalgets arbeid er å utrede hvordan regelverk for framtidens apotek bør innrettes, samtidig som de helsepolitiske målsettingene ivaretas.
Utvalgets hovedoppgaver (mandat)
Utvalget skal vurdere regelverk som knytter seg til apotekvirksomhet. Utredningen omfatter apotekvirksomhet generelt, men utvalget skal spesielt vurdere behovet for reguleringer som skal legge til rette for økt konkurranse og nye apotekløsninger. Sentralt i utredningen er en samlet gjennomgang av erfaringer med gjeldende apotek- og grossistregelverk som vil danne grunnlag for utvalgets vurdering av og forslag til ny eller endret lovregulering og eventuelt andre tiltak. Utvalget bes også om å redegjøre for regulering og markedssituasjonen i andre land.
Marked- og konkurransesituasjon
Utvalget skal vurdere om dagens marked fungerer slik at det bidrar til å underbygge de legemiddelpolitiske målene. I tilknytning til dette bes utvalget også om å vurdere konkurransesituasjonen i markedet. I dette arbeidet inngår en vurdering av om gjeldende regler om konsesjon til eierskap til apotek, og den etablerte kjedestrukturen bidrar til å begrense konkurransen og etableringen av nye apotek og apotekformer. Utvalget bør også vurdere om målet om lavest mulig pris er oppnådd for områder med og uten tredjepartsfinansiering. Utvalget skal vurdere om lovgivningen bør endres med sikte på bedret oppfyllelse av de legemiddelpolitiske målene og bedret konkurranse i markedet. Dette kan for eksempel være regler som bedre legger til rette for etablering av nye apotekformer, som nettapotek, og bruk av nye teknologiske løsninger i apotek. Utredningen bør beskrive den teknologiske utviklingen samt utviklingen av nye apotekformer. Utvalget skal se nærmere på forhold mellom teknologisk utvikling og apotekenes roller og oppgaver, og vurdere hvordan utviklingen påvirker disse. Eventuelle forskjeller mellom fysisk apotek og nettapotek skal fremheves. Utvalget bes særlig vurdere hvilke konsekvenser forslagene kan ha for å sikre pasientene rask tilgang til legemidler og andre varer samt at alle deler av landet har tilgang til legemidler og farmasøytiske tjenester, som har god kvalitet og rimelig pris.
Samhandling
God samhandling mellom apotek og helsepersonell samt andre deler av helsetjenesten er en forutsetning for god pasientbehandling og at legemidler utleveres og brukes riktig. Utvalget bør kartlegge hvordan samhandlingen foregår i dag, samt behov i lys av nasjonale e-helseløsninger som er i bruk og under utvikling. I dette arbeidet bes utvalget å vurdere om de tilgjengelige teknologiske mulighetene og samhandling med andre aktører utnyttes på en hensiktsmessig måte. Utvalget bes peke på eventuelle begrensninger i regelverket som begrenser effektiv samhandling mellom apotek og andre aktører i helsetjenesten og foreslå endringer utvalget finner nødvendig.
Apotekenes rammevilkår og roller
Utvalget bes også å vurdere apotekenes rammevilkår i dag. Kostnader og avanse i de ulike ledd av forsyningskjeden skal skisseres, herunder rammevilkårene til de vertikalt integrerte kjedene sammenlignet med uavhengige apotek og sykehusapotek. Utvalget skal sammenligne nåværende situasjon samt de senere års utvikling av rammevilkår i Norge med andre land, og identifisere mulige forhold som kan bidra til å forklare forskjellene. Utvalget skal videre vurdere om myndighetsregulert kompensasjon, herunder apotekavanse, avanse for medisinsk forbruksmateriell, næringsmidler og kompensasjon for andre tjenester som det offentlige finansierer samt støtteordninger er formålsrettet og egnet til å understøtte legemiddelpolitiske mål.
Utvalget skal vurdere om det er behov for endringer i finansiering som følge av foreslåtte endringer, herunder endringer i avansemodellen og driftsstøtteordningen. En vurdering av dagens modells egnethet til å fremme innovasjon og økt bruk av teknologi samt digital samhandling bør inngå. I tilknytning til dette skal utvalget også kartlegge hvordan apotek utfører sine lovpålagte oppgaver knyttet til tilgang og utlevering av legemidler, herunder i beredskaps- /mangelsituasjoner. Videre skal det kartlegges hvordan apotekene bidrar til riktig legemiddelbruk, både ved utlevering av reseptpliktige og reseptfrie legemidler, samt handelsvarer gjennom bruk av apotektjenester og ved råd og veiledning rettet mot befolkningen og den enkelte sluttbruker.
Med sikte på den fremtidige innretningen av helsetjenesten, kan utvalget vurdere hvordan det kan legges til rette for at apotek fortsatt innehar nødvendig kompetanse og for at denne benyttes best mulig for å fremme riktig legemiddelbruk. Utvalget kan også se på i hvilken grad faglige tjenester i apotek bør videreutvikles og integreres i helsetjenesten, og mulige konsekvenser av dette. Utvalget kan i tilknytning til dette vurdere hvordan befolkningens tilgang til helsetjenester kan bedres, blant annet gjennom tilgang til fysiske apotek og økt bruk av teknologi. Mulige utviklingstrekk for apotekenes roller, herunder nye roller og samhandlingsløsninger kan skisseres i ulike scenarier, sammen med forslag til ulike finansieringsløsninger for slike tjenester.
Ev. økonomiske konsekvenser for aktørene som følger av foreslåtte endringer i regelverk skal hensyntas. Alternativer til dagens modell for finansiering skal vurderes. Utvalget skal vurdere økonomiske og administrative konsekvenser av sine forslag til tiltak, samt konsekvenser av tiltak sett fra bl.a. et brukerperspektiv, i tråd med kravene i utredningsinstruksen. Utvalget skal videre utarbeide utkast til nødvendige endringer i lov og forskrifter.
Utvalget skal avgi sin utredning innen 1. januar 2023.
1.2 Utvalgets sammensetning
Apotekutvalget har hatt følgende medlemmer:
Tore Bråthen, professor, Oslo (leder)
Beate Berrefjord, avdelingsdirektør Konkurransetilsynet, Bergen
Felix Kamal Ally, apoteker, Drammen
Hans Olav Melberg, professor, Tromsø
Harald Dale, pensjonist, Karmøy
Inger Cecilie Jørstad, spesialrådgiver, Tromsø
Katrine Bryne, seniorrådgiver Legemiddelindustrien, Oslo
Lilly Ann Elvestad, generalsekretær Funksjonshemmedes Fellesorganisasjon, Oslo
Marit Hermansen, sjeflege i NAV, Grue
Oddbjørn Tysnes, spesialrådgiver Apotekforeningen, Oslo
Stig Henning Pedersen, driftsdirektør, Sandefjord
Thomas Bäckstrøm, apoteker, Sarpsborg
Turid Vollan Riset, assisterende banksjef, Melhus
Urd Andestad, leder Norges Farmaceutiske Forening, Oslo
1.3 Utvalgets arbeid
Møter
Utvalget har hatt 17 utvalgsmøter, hvorav 16 heldagsmøter og ett møte over to påfølgende dager. Den første tiden ble utvalgets arbeid påvirket av koronasituasjonen, særlig reise- og møterestriksjoner som følge av denne. Det var nødvendig å gjennomføre to av utvalgsmøtene som heldigitale møter. For øvrige utvalgsmøter ble det tilrettelagt for både fysisk og digital deltakelse.
Sekretariatet har bestått av:
utredningsleder Carolin Hagen (sekretariatsleder, Helse- og omsorgsdepartementet)
seniorrådgiver Per Thomas Thomassen (Helse- og omsorgsdepartementet)
seniorrådgiver Børge Myrlund Larsen (Helsedirektoratet)
legemiddelinspektør Mona Wensaas Kinn (Statens legemiddelverk).
Førstekonsulent Helene Sophie Michelet (Helse- og omsorgsdepartementet) har bidratt med administrative og faglige innspill.
Dialog med øvrige interessenter
Følgende representanter fra interesseorganisasjoner og næringsliv samt fagpersoner og forskere har holdt innlegg for utvalget (i kronologisk rekkefølge):
Line Skåtøy (Unge funksjonshemmede)
Venche Fagereng (Stoffskifteforbundet)
Jørgen Huse (pensjonist, tidligere Statens legemiddelverk)
Eli Skeid (fastlege)
Tove Borgen (fastlege)
Marte Kvittum-Tangen (Norsk forening for allmennmedisin)
Nils Kristian Klev (Allmennlegeforeningen)
Dag Morten Dalen (Handelshøyskolen BI)
Erling Ulltveit (Legemiddelindustrien)
John Lind-Nilsen (Legemiddelgrossistforeningen)
John Billy Nenningsland (Apotekergruppen)
Per Lund (Apotekforeningen)
Markus Carlmar Løveid (Bandasjistenes næringsutvalg)
Simona Motrogan (VESO)
Therese Vårli Kvenseth (VESO)
Tore Åge Tobiassen (Vitusapotek Evenskjer)
Lene Strand (Norsk Medisinaldepot AS (NMD))
Kurt Haga (NMD)
Gro Miller (Apotek 1 Gruppen AS)
Ingvild Mauseth (Apotek 1 Gruppen AS)
Patrick Hjetland (Apotera AS)
Tone Rojahn (Sykehusapotekene HF)
Ane Andersen (Stavanger kommune)
Gerhard Anthun (Virke)
Aleksi Westerholm (Helsedepartementet i Finland)
Lars Erik Fagernæs (Aviant)
Espen Moen (Handelshøyskolen BI)
Kathrine Lavik Tvedt (Konkurransetilsynet)
Arne Krokan (Norges teknisk-naturvitenskapelige universitet)
Rune Røren (Direktoratet for e-helse)
Ingunn Tho (Universitetet i Oslo)
André Bregård (Novo Nordisk)
Ali Areffad (Bristol-Myers Squibb)
Daniel Sørli (Dr. Dropin)
Atle Riksfjord (Eika)
Magnus Isacson (Svensk Forening for allmennmedisin)
Espen Hetty Carlsen (Direktoratet for e-helse)
Anne-Lise Härter (Apotekforeningen)
Anne Gerd Granås (Universitetet i Oslo)
Hanne Andresen (Apotekforeningen)
Ellen Karine Håkonsen (Apotek 1 gruppen AS)
Kirsten Hjelle (Helsedirektoratet)
Elin Ørjasæter (Høyskolen Kristiania Oslo)
Hans-Petter Johannessen (Sykehusapotekene HF)
Elisabeth Haug (Farmasiet AS)
Bjarni Siggurdsson (Helsedepartementet i Island)
Øyvind Winther (Apotek 1 Gruppen AS)
Anders Larsson (Alliance Healthcare Norge AS/ Alliance Healthcare Norge Apotekdrift AS)
Terje Kvaal (NMD)
Sverre Engelschiøn (Helse- og omsorgsdepartementet)
Janne Kutschera Sund (Helseplattformen)
Therese W. Bakke (Helsedirektoratet)
Utvalget har også besøkt Vitusapotek Storo.
Eksterne utredninger
I tillegg til bruk av sekundærkilder, ble det bestilt følgende tallgrunnlag og analyser:
Innhenting av tall og fakta om apotek gjennom Apotekkartleggingen og Apotekstatistikken (Statens legemiddelverk (Legemiddelverket))
Prisundersøkelse om reseptfrie legemidler (Oslo Economics)
Kartlegging av regulering av sykehusapotek (Norske Sykehusfarmasøyters Forening)
Undersøkelse om avstand til apotek (Universitet i Tromsø)
Innspill til utvalget
Utvalget har informert om arbeidet gjennom nyhetssaker på regjeringen.no (Helse- og omsorgsdepartementet, 2021). Innspill kunne sendes til utvalgets e-postadresse fortløpende. Gjennom separate innspillsrunder innhentet utvalget innspill om markeds- og konkurransesituasjon, bruk av apotek, kvalitet i apotek, og apotekenes og grossistenes rammevilkår. Oversendte innspill har tatt opp spørsmål om utdanning og kompetanse for helsepersonell i apotek, vertikal integrasjon, og grossistenes og apotekenes rammevilkår. Alle innspill ble gjennomgått og drøftet i utvalgets møter.
Internasjonale sammenligninger
Internasjonale sammenligninger baseres på rapporter fra nasjonale helsemyndigheter, internasjonale helse- og interesseorganisasjoner samt fagmøter med nasjonale myndigheter. Ytterlige informasjon ble innhentet gjennom fagmøter mellom utvalgets sekretariat og helsemyndigheter i Danmark, Estland, Finland, Island og Sverige.
Det er videre foretatt en kartlegging av regulering av sykehusapotek i andre land. Norske Sykehusfarmasøyters Forening har bistått med innhenting av data.
1.4 Utvalgets forståelse og tolkning av mandatet og avgrensninger
Utvalget har oppfattet sitt mandat slik at forslagene som legges frem, skal vurderes i lys av legemiddelpolitisk måloppnåelse. Utvalget forstår mandatet slik at myndighetene ønsker en regulering av apotekvirksomhet som ivaretar fremtidig utvikling i markedet hensyntatt den teknologiske utviklingen. Utvalget, har derfor utarbeidet forslag til endringer som skal gi et mer fleksibelt og teknologinøytralt fremtidsrettet regelverk for apotekvirksomhet.
Utvalget legger frem forslag til lovtekst for endringer i apotekloven. Utvalget har imidlertid ikke sett det som hensiktsmessig å legge frem forslag til forskrifter, fordi ny forskriftstekst vil avhenge av Stortingets behandling av et eventuelt lovforslag. Videre vurderer utvalget at enkelte aktuelle forskriftsendringer vil kreve ytterligere utredning enn det utvalget har hatt anledning til. Utvalget legger derimot frem flere forslag til hvordan lovforslag kan utdypes og presiseres i forskrifter.
Mandatet la opp til at utvalget også kunne vurdere behov for endringer i andre lover og forskrifter enn de som knytter seg direkte til apotekvirksomhet. Utvalget har vurdert endringer i den grad det har vært av betydning for sentrale problemstillinger i mandatet. I tilknytning til konkurransesituasjonen har utvalget funnet det relevant å vurdere endringer i grossistregelverket.
Utvalget har ikke hatt tilgang til tilstrekkelig kunnskapsgrunnlag eller tid til å foreta en helhetlig vurdering av kan-punktene i mandatet om fremtidig bruk av kompetanse og tjenester. Gitt et begrenset kunnskapsgrunnlag og utvalgets sammensetning, kan ikke disse punktene besvares på en tilfredsstillende måte. Området må videre ses i sammenheng med andre utredningsarbeid, herunder Helsepersonellkommisjonen og arbeidet med Nasjonal helse- og samhandlingsplan. Utvalget har derfor ikke foretatt kan-vurderingene. I stedet peker utvalget i kapittel 13.3 på noen overordnede problemstillinger for fremtidige vurderinger, og løfter noen sentrale spørsmål knyttet til fremtidig bruk av farmasøytisk kompetanse som bør vurderes i videre utredningsarbeid.
2 Sammendrag
NOU 1997: 6, som ligger til grunn for dagens apoteklov, ble lagt frem for 25 år siden. Dagens lovverk ble derfor ikke gitt med tanke på å omfatte nye apotekløsninger eller muligheter for distribusjon og samhandling som den teknologiske utviklingen har muliggjort.
Dagens apoteklov trådte i kraft i 2001, og innebar store endringer i markedsstrukturen. Loven åpnet blant annet for at grossister kan eie apotek, med den følge at tre vertikalt integrerte apotekkjeder etablerte seg i Norge. I dag har om lag 94 prosent av apotekene i Norge tilknytning til en av kjedene, enten gjennom eierskap eller medlemskap, mens henholdsvis tre prosent er frittstående apotek uten kjedetilknytning og tre prosent er sykehusapotek. Siden 2001 har antall apotek og ansatte mer enn doblet seg, og antall apotek øker hvert år.
Myndighetene har et ansvar for å sikre god tilgang til sikre og effektive legemidler. Apoteklovens formål ifølge apotekloven § 1-1 er å sikre forsvarlig utlevering av legemidler til sluttbruker. Loven skal medvirke til riktig legemiddelbruk i befolkningen og til god tilgjengelighet i alle deler av landet til legemidler og farmasøytiske tjenester som har god kvalitet og rimelig pris.
Apotek er bemannet med høyt kvalifisert personale, og regelverket stiller detaljerte krav til drift og oppgaveløsning. Noen oppgaver er knyttet til distribusjonen av legemidler, som for eksempel forhandlingsplikt, leveringsplikt og lagerplikt. Andre oppgaver skal bidra til riktig legemiddelbruk. Dette gjelder eksempelvis informasjons- og veiledningsplikten samt kravet om farmasøytkontroll av alle resepter og rekvisisjoner.
Apotekpersonale er i mange land en gruppe helsepersonell som er lett tilgjengelig for befolkningen. Slik er det også i Norge. I 2021 hadde apotek i Norge 56,2 millioner kundebesøk. Farmasøyter er ansatt i hele helsesektoren, men majoriteten av norske farmasøyter arbeider i apotek og sørger daglig for at pasientene får de legemidlene de skal ha. BIs kundebarometer viser at brukerne har høy tilfredshet med apotek, og at bransjen skårer høyt sammenlignet med andre bransjer.
Samtidig er også apotekdrift kommersiell virksomhet. Apotek har enerett til salg av alle reseptpliktige og mange reseptfrie legemidler, og konkurransen om kundene gjør seg derfor primært gjeldende i valget mellom ulike apotekaktører. Både kunder og samfunnet som helhet har interesse av et velfungerende apotekmarked som fremmer apoteklovens formål og de legemiddelpolitiske målene. Samtidig er det flere elementer som skiller salg av legemidler fra salg i andre markeder, som for eksempel regulering av priser og avanse for reseptpliktige legemidler og stor grad av tredjepartsfinansiering.
Apotekmarkedet er i endring. Adgang til internettsalg har medført at en større andel av salg av legemidler skjer via nettapotek. Ny teknologi gir muligheter for effektivisering av drift, men også nye måter for å løse apotekenes oppgaver og å samhandle med kunder, øvrig helse- og omsorgstjeneste og myndigheter. Det er innført ulike tjenester i apotek, både med og uten offentlig finansiering.
Utvalgets overordnede formål har vært å utrede hvordan det fremtidige apotekregelverket skal innrettes, samtidig som de helsepolitiske målsettingene ivaretas. Utvalget slutter seg til tidligere vurderinger om at det er et behov for særskilt reguleringer av apotek. Apotekene medvirker til riktig legemiddelbruk gjennom kontroll av rekvirering, samhandling med helsetjeneste lokalt, informasjons- og veiledningsplikt overfor helsetjeneste, befolkning og pasienter samt ivaretakelse av etterspørsel av varer og tjenester for egenomsorg. Alle oppgavene forutsetter både høy kompetanse og tilstrekkelig kapasitet i apoteket.
Mandatet oppgir tre hovedområder som utvalget er bedt om å vurdere. Utvalgets overordnede funn oppsummeres under.
2.1 Utvalgets funn
Markeds- og konkurransesituasjonen
Det er etablert et marked med tre vertikalt integrerte aktører. Det er ikke etablert nye vertikalt integrerte grossister siden 2001, til tross for at fullsortimentskravet er fjernet for å tilrettelegge for flere etableringer. Dette kan tyde på at det kan være krevende å etablere slik grossistvirksomhet i Norge. Krav om leveringsplikt til alle landets apotek innen 24/48 timer og andre regulatoriske krav, oppgis som etableringshindringer i grossistleddet.
Det er en høy etableringstakt av nye apotek, og beliggenhet er en av flere konkurranseparametere. I tillegg til etablering av fysiske apotek, har enkelte nettapotek etablert seg siden 2016. Nettapotekene konkurrerer blant annet ved å tilby reseptfrie legemidler og handelsvarer til en lavere pris, og ved å tilby ulike alternativer for levering. Markedsandelen for netthandel i 2021 er lavere enn i andre bransjer. Utvalget konkluderer med at dagens marked, herunder reglene om at grossister kan eie apotek og den etablerte kjedestrukturen, bidrar til å begrense konkurransen og hever terskelen for etableringen av nye apotek og apotekformer som ikke har tilknytning til de tre vertikaleide apotekkjedene.
De gjeldende eierskapsreglene og det etablerte markedet har imidlertid også hatt flere positive effekter. Etter en samlet vurdering mener derfor utvalgets flertall at den etablerte kjedestrukturen har bidratt til å ivareta apoteklovens formål om god tilgjengelighet til legemidler i store deler av landet. Flertallet foreslår derfor å videreføre gjeldende regler om grossisters leveringsplikt, men foreslår flere tiltak for å legge til rette for økt konkurranse som også kan bidra til økt etablering av nye apotekformer.
Det er ikke tegn til nevneverdig priskonkurranse mellom apotek for prisregulerte, reseptpliktige legemidler i blåresept- og hvitreseptmarkedet. Tidligere prisundersøkelser samt undersøkelsen gjennomført i forbindelse med dette arbeidet antyder at det er noe priskonkurranse på reseptfrie legemidler. Prisen varierer imidlertid mellom ulike utsalgssteder, og fysiske apotek ser ikke ut til å delta i konkurranse om pris i særlig grad. Utvalget mener at målene om rimelig pris og lavest mulig pris ikke blir ivaretatt gjennom dagens apoteklovgivning og etablerte marked, men i stedet ivaretas primært gjennom annet regelverk.
Utvalgets flertall foreslår flere tiltak med sikte på å gjøre det fremtidige apotekregleverket teknologinøytralt. Blant annet foreslås det å fjerne apoteklovens krav om at apotek skal være fysisk tilgjengelig for publikum, samt å fjerne kravet om at all kjernevirksomhet i apotek skal foregå i lokalet som er ment å være apotekets hovedlokale, og erstatte dette med et generelt krav om at virksomheten skal drives forsvarlig. Flertallet forslår også å fjerne kravet om at apotekets øvrige lokasjoner skal ligge i geografisk nærhet til hverandre.
Samhandling
God samhandling mellom apotek og helsepersonell samt andre deler av helse- og omsorgstjenesten er en forutsetning for forsvarlig pasientbehandling og for at legemidler utleveres og brukes riktig. Utvalget har kartlagt hvordan samhandlingen foregår i dag, og mener det er behov for løsninger som bedrer og effektiviserer samhandlingen. Slike nasjonale e-helseløsninger er enten tatt i bruk, er under planlegging eller under utvikling. Overordnet finner ikke utvalget at dagens regelverk er til hinder for at det kan utvikles løsninger for effektiv samhandling mellom apotek og andre aktører i helse- og omsorgstjenesten.
Apotekenes rammevilkår og roller
Apoteklovgivningen må være innrettet slik at den bidrar til å opprettholde et apotektilbud til hele befolkningen og de ulike innbyggernes behov. Apotek skal være en arena der det ytes helsehjelp, og hvor det skal være fokus på kjerneoppgavene.
For at apotek skal fylle sin rolle med hensyn til forsvarlig utlevering av legemidler til sluttbruker samt medvirke til riktig legemiddelbruk, er det behov for stabile overordnede rammevilkår som bidrar til å sikre tilgjengelighet og faglig forsvarlig drift.
Ut fra tilgjengelig informasjon finner utvalget at rammevilkårene for aktørene i grossist- og apotekleddet synes å være stabile over tid. Utvalget vurderer at økningen i antall apotek kan peke i retning av at de samlede økonomiske rammevilkårene for eiere, grossister og apotek er gode. Et stort antall apotek driftes imidlertid med tap. De alle fleste av disse er lokalisert i sentrale strøk og er kjedeeid. Økonomiske gevinster kan også tas ut i grossistleddet eller det kan være andre grunner til å opprettholde et apotek selv om det går med tap isolert sett. Basert på de funn som foreligger, har utvalget ikke grunnlag for å konkludere med at disse apotekene vil forsvinne. Utvalget har heller ikke grunnlag for å anta at befolkningens tilgang til apotek i mindre sentrale strøk ligger an til å bli svekket.
Utvalget fremholder at farmasøytisk kompetanse er viktig for å oppnå de legemiddelpolitiske målene og målet om bedre folkehelse. Etter utvalgets vurdering må god utnyttelse av de innsatsfaktorene man har være et førende prinsipp for å oppnå sentrale samfunnsmål, herunder god folkehelse. Utvalget understreker at den farmasøytiske kompetansen er apotekets viktigste ressurs, og at forholdene bør legges til rette for at denne kan utnyttes på en effektiv måte. Sentrale spørsmål knyttet til fremtidig bruk av farmasøytisk kompetanse bør inngå i videre utredningsarbeid.
Utvalget peker på at uavhengig, dokumentert effekt bør ligge til grunn for offentlig finansierte helsetjenester, også dersom disse gjennomføres i apotek. Videre er det av sentral betydning at eventuelle fremtidige offentlig finansierte tjenester i apotek er et supplement til, og ikke unødvendig overlapper med, øvrige helsetjenester. Dette forutsetter at det er klare ansvarsforhold og tydelige vekslinger mellom tilgrensende tjenester, samt at apotek har tilstrekkelig ressurser og kompetanse slik at de fremstår som robuste faglige enheter, som også kan ivareta oppgaver som krever samhandling på en effektiv måte.
2.2 Om rapporten
Utvalgets rapport er strukturert i tre deler. I det følgende gis en kort oversikt over innholdet i de ulike kapitlene.
DEL I Introduksjon
Kapittel 1 Innledning
I kapittel 1 presenteres utvalgets sammensetning og mandat. Det redegjøres for utvalgets arbeidsprosess, herunder dialog med interessenter og fagpersoner, håndtering av innspill, eksterne utredninger satt i bestilling, og grunnlaget for internasjonale sammenlikninger. Videre gis en beskrivelse av utvalgets tolkning av mandatet, samt avgrensninger og begrunnelsen for disse.
Kapittel 2 Sammendraget
Kapittel 2 beskriver bakgrunnen for utredningen, utvalgets funn og vurderinger samt strukturen i utredningen.
Kapittel 3 Historisk utvikling og bakgrunn
Kapittel 3 beskriver den historiske fremveksten av det norske apotekvesenet. Det gjengis hovedtrekk fra legemiddelmeldingene fra henholdsvis 2005 og 2015 som danner grunnlag for de fire legemiddelpolitiske målsetningene. Kapitlet inneholder også en beskrivelse av relevante endringer i apotekregelverket i årene etter 2001, med særlig fokus på at det i 2009 ble åpnet opp for salg av legemidler over internett. Nye muligheter for konkurranse og samhandling som følge av ny teknologi beskrives overordnet, herunder hvordan dette danner bakgrunnen for utvalgets mandat og arbeid.
Kapittel 4 Gjeldende rett
I kapittel 4 gjennomgås regelverket for legemidler og medisinsk utstyr, samt gjeldende regulering av aktørene som utgjør forsyningskjeden for legemidler. Det redegjøres for gjeldende apoteklovs formål, samt plikter og krav som følger av regelverket. Apotekenes lovpålagte oppgaver beskrives nærmere i kapittel 7. Videre redegjøres det for regelverket for pris og refusjon av legemidler, medisinsk forbruksmateriell og næringsmidler, og i den forbindelse også apotekavansen. Kapitlet avsluttes med en gjennomgang av konkurranselovgivningen.
Kapittel 5 Legemiddelforsyningen i Norge
I kapittel 5 gjennomgår utvalget dagens markedsstruktur og forsyningskjeden for legemidler i Norge. Aktørene i verdikjeden, fra produsent via grossist og detaljist til sluttbruker, beskrives. Kapitlet beskriver utviklingstrekk i markedet i de senere årene, herunder knyttet til tilgjengeligheten til apotek, kjedetilknytning og eierskap, og fremvekst av nye apotektyper som nettapotek. Det gis også en oversikt over omsetningen i Norge, fordelt på ulike produktsegmenter. Omsetningsfordeling og avanse i de ulike markedssegmentene beskrives. Kapitlet gir videre en nærmere beskrivelse av systemene for prisfastsettelse. Avslutningsvis beskrives trender og konsekvenser av legemiddelmangel.
Kapittel 6 Beskrivelse av konkurransesituasjonen
For å kunne vurdere konkurransesituasjonen gjennomgås særtrekk som skiller apotekmarkedet fra andre markeder, herunder fri etablering av apotek- og grossistvirksomhet, vertikal integrasjon mellom detaljist- og grossistledd, og regulering av legemiddelpriser og apotekavanse for reseptpliktige legemidler. Konkurransesituasjonen i markedet og utfordringsbildet kan oppleves ulikt for ulike aktører. Utvalget gjengir derfor funn fra en undersøkelse av opplevd konkurransesituasjon om konkurranseintensitet, trender og utviklingstrekk samt etablerings- og veksthindringer for henholdsvis produsent, grossist og ulike apotektyper. Innspill om konkurransesituasjon fra andre aktører beskrives også.
Utvalget er bedt om å vurdere om målet om lavest mulig pris er oppnådd for områder med og uten tredjepartsfinansiering. Funn om priskonkurranse i markedet legges frem i kapitlet.
DEL II Utvalgets kartlegginger og analyser
Kapittel 7 Om apotek
I kapittel 7 gjennomgås apotekenes lovpålagte oppgaver og plikter, som forhandlingsplikt, leveringplikt, lagerplikt, krav knyttet til reseptekspedisjon og farmasøytkontroll, samt informasjons- og veiledningsplikten. Øvrige plikter beskrives også. Kapitlet redegjør for erfaringer og funn fra relevante tilsynsmyndigheter. Kapitlet gjennomgår dagens tilbud av veiledningstjenester, apotekenes rolle i legemiddelassistert rehabilitering, og andre tjenester som oppstartsveiledning og vaksinasjon. Krav knyttet til forsendelse av legemidler samt apotekenes rolle i legemiddelberedskapen, beskrives.
Det redegjøres for regulatoriske krav til kompetanse og kapasitet i apotek. Utvalget har kartlagt kompetansen i apotek slik den er i dag samt utviklingen av kompetanse og tilgang til autorisert helsepersonell over tid. Utdanningskapasitet og tilgang til farmasøytkompetanse beskrives. Videre oppsummeres tilbakemeldinger fra apotekaktørene.
Ulike apotekformer og aktører og deres utvikling over tid beskrives. Kapitlet redegjør for nye konsepter i fysiske apotek, samt fremveksten av nettapotek.
Videre presenteres sentrale funn knyttet til apotekenes rammevilkår i dag. Det redegjøres for eierstrukturer i markedet, inkludert økonomiske resultater i tilhørende virksomheter. Utvalget har sett nærmere på utvikling av omsetning og driftsmarginer for ulike apotekformer og utvikling i etableringer over tid. Kapitlet gjennomgår apotekavansen og annen myndighetsregulert kompensasjon.
Kapittel 8 Teknologisk utvikling og samhandling
I dette kapitlet beskrives utviklingstrekk i den digitale utviklingen, med fokus på digitalisering for trygg og effektiv legemiddelbruk. Kapitlet gir eksempler på teknologisk utvikling i apotek, inkludert nye metoder for databehandling, effektivisering og automatisering av ulike arbeidsprosesser og bruk av digitale verktøy for kompetanseutvikling, opplæring og kommunikasjon. Den teknologiske utviklingens betydning for tilvirkning og administrasjon av legemidler beskrives. Kapitlet gjennomgår også nasjonale e-helseløsninger med betydning for legemiddelområdet. Videre beskrives apotekenes plikt og behov for å samhandle, og det redegjøres for hvordan samhandling i dag gjennomføres med henholdsvis helse- og omsorgstjenesten, sluttbrukere, myndigheter og i forsyningskjeden. Kapitlet gjennomgår også krav knyttet til håndtering av person- og helseopplysninger.
Kapittel 9 Brukere
Kapittel 9 fokuserer på brukere av legemidler utenfor sykehus og institusjon. Kapitlet omtaler pasientenes behov og forventninger på et overordnet nivå, med henblikk på mulige problemstillinger i relasjonen bruker – apotek. Ulike forhold ved legemiddelbrukeren beskrives, med fokus på særtrekk som skiller brukeren av legemidler fra forbrukere i andre markeder. Det redegjøres for brukeres behov og forventninger knyttet til produkttilgang for ulike legemiddelsegmenter, herunder konsekvenser av legemiddelmangel. Kapitlet drøfter videre tilgang til informasjon og veiledning, trygghet og tillit, samt forbrukernes forventninger og forbrukermakt.
Kapittel 10 Regulering og marked i andre land
Utvalget redegjør i dette kapitlet for regulering, markeds- og konkurransesituasjon og rammevilkår i andre land på bakgrunn av gjennomgåtte rapporter og intervjuer med fageksperter fra offentlige myndigheter i enkeltland. Videre gjengis funn fra en kartlegging av reguleringen av sykehusapotek i europeiske land. Kapitlet behandler krav til faglige kvalifikasjoner for farmasøyter og teknisk personell, etableringskriterier, regulering knyttet til eierskap, apotekenes plikter, omsetning av varer og tjenester, pris- og avanseregulering og offentlige støtteordninger. Regulering, markedet og konkurransesituasjonen, samt offentlig kompensasjon gjennomgås særskilt for Danmark, Finland og Sverige. Avslutningsvis gjengis internasjonale utviklingstrender knyttet til netthandel.
DEL III – Utvalgets vurderinger og anbefalinger
Kapittel 11–15 Funn, vurderinger og anbefalinger
Kapittel 11 til 15 oppsummerer sentrale funn og vurderinger, det redegjøres videre for utvalgets anbefalinger. Utvalgets overordnede premisser, samt flertallets anbefalinger oppsummeres i figur 2.1.
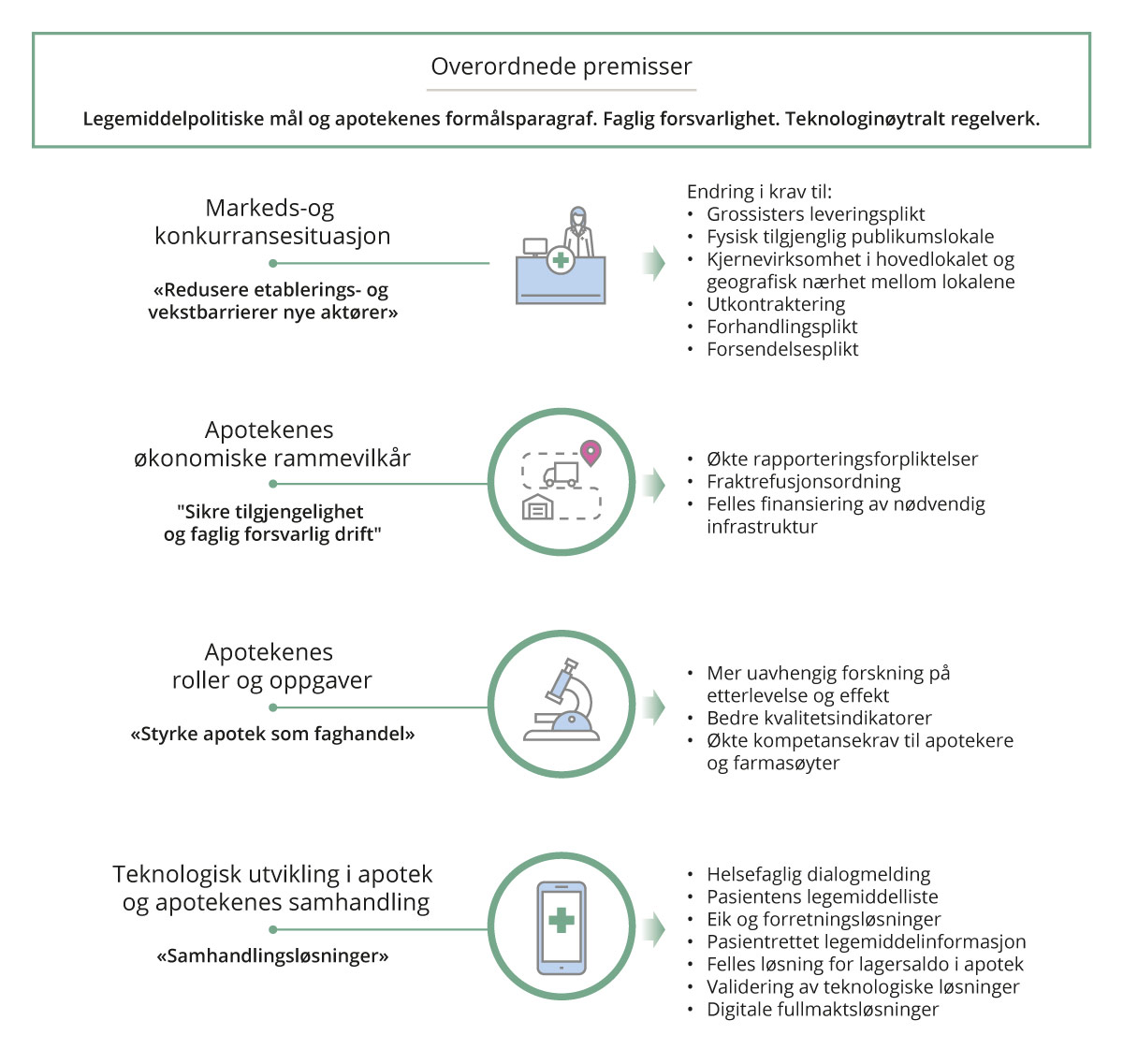
Figur 2.1 Overordnete premisser og utvalgets flertalls anbefalinger
Kapittel 16 Konsekvenser
I kapittel 16 vurderer utvalget tiltakenes betydning for legemiddelpolitisk måloppnåelse. Økonomiske og administrative konsekvenser som følge av de ulike endringsforslagene utvalgets flertall fremmer, er også omtalt. Kapitlet inneholder videre en omtale av forslag til tiltak som krever nærmere utredning.
Kapittel 17 Merknader til de enkelte bestemmelsene
Kapittel 17 inneholder merknader til de enkelte lovbestemmelsene som er foreslått av utvalgets flertall.
Kapittel 18 Lovutkast
Forslag til lovendringer som følge av foreslåtte endringer fra utvalgets flertall, fremkommer av dette kapitlet.
3 Historisk utvikling og bakgrunn
3.1 Innledning
Kapitlet gir et kort historisk tilbakeblikk på hvorfor apotekvesenet oppsto og en gjennomgang av utviklingen i forsyningskjeden for legemidler før og etter 2001. Kapitlet går deretter nærmere inn på utviklingen av legemiddelpolitiske mål samt legemiddelmeldingene fra henholdsvis 2005 og 2015. Kapitlet beskriver også utviklingen i regelverket som danner bakgrunnen for utvalgets arbeid.
3.2 Historisk skille mellom farmasi og medisin
Mennesket har svært langt tilbake i historien brukt midler fra plante-, dyre-, og mineralriket ved sykdom. Det formelle skillet mellom medisin og farmasi oppsto sannsynligvis på Sicilia i første halvdel av 1200-tallet, gjennom det såkalte Salernoediktet. Her ble det fastsatt et klart skille mellom leger og de som fremstilte legemidler. Fremstillingen skulle foregå etter en nærmere beskrevet fremgangsmåte. Myndighetene skulle fastsette prisene på legemidlene, og apoteknæringen skulle ikke være fri, men avhengig av konsesjon eller privilegium. Fra Italia spredte apotekene seg til resten av Europa. Virksomheten ble da regulert ved lover som var i tråd med Salernoediktet.
Det første apoteket i Norge ble opprettet i Bergen i 1595. Skillet mellom leger og apotek samt kravet om at leger ikke kunne eie apotek ble innført i Danmark og Norge ved Christian den femtes forordning av 4. desember 1672. Skillet mellom salg av legemidler og rekvirering av legemidler har gjennom historien vært viktig for å hindre utilbørlig påvirkning i valg av legemidler. Frem til midten av 1900-tallet foregikk en stor del av legemiddelproduksjonen i Norge i apotekenes laboratorier.
3.3 Situasjonen før apotekreformen i 2001
Strukturen i markedet for legemiddelforsyning endret seg betydelig i 1995 da grossistmonopolet som Norsk Medisinaldepot hadde hatt, falt bort som følge av EØS-avtalen. To nye legemiddelgrossister, Tamro og Holtung, etablerte seg. Dette la grunnlaget for nåværende tredeling av grossistmarkedet.
Før dereguleringen av apotekvesenet 1. mars 2001 gjaldt lov om drift av apotek av 21. juni 1963 nr. 17. Alle apotek, med unntak av sykehusapotek, var eid av enkeltpersoner med norsk farmasøytisk embetseksamen (cand. pharm.) eller tilsvarende utdanning samt relevant praksis. De hadde rett og plikt til å drive apotek og eventuelle filialapotek som enkeltpersonforetak med personlig ansvar for apotekets økonomi. Apotek hadde enerett på salg og utlevering av legemidler. Beslutning om etablering eller nedleggelse av apotek lå hos Statens helsetilsyn (Helsetilsynet). I perioden 1991–2000 ble det etablert 71 nye apotek. Den 1. januar 2001 var det 397 apotek i Norge.
Helsepolitiske mål for apoteknæringen i perioden før 2001 omtales i St.meld. nr. 41 (1987–88) Helsepolitikken mot år 2000. Nasjonal helseplan. Her heter det blant annet at:
«Hovedmålet for apotekvesenet må være å yte best mulig farmasøytisk service. (…) Innenfor den overordnede målsetting må apotekvesenet bidra til:
at befolkningen i alle deler av landet får rimelig lett og sikker adgang til effektive og høyverdige legemidler til lavest mulig pris og med ens utsalgspris over hele landet.
at ressursene blir hensiktsmessig fordelt innenfor legemiddelsektoren. Videre bør apotekvesenet medvirke til betryggende forhold på felter som grenser opp med legemiddelområdet.»
Om apotekenes roller med hensyn til ovennevnte mål heter det at:
«1. Det må sikres tilstrekkelig tilgang på legemidler. Befolkningen i alle deler av landet må ha rimelig lett adkomst til apotektjeneste. Publikum bør få den service de har behov for uten unødig forsinkelse.
2. Legemidlene må være av god kvalitet. Sikkerhetstiltakene i systemet og apotekenes ekspedisjonsrutiner må være betryggende.
3. Det må treffes tiltak som kan sikre forsvarlig og medisinsk riktig legemiddelbruk såvel i som utenfor institusjon. Nødvendig informasjon om legemiddelspørsmål må nå frem til alt helsepersonell som har tilknytning til medisinforsyningen. Apotekene må engasjeres i en med den øvrige helsetjeneste samordnet virksomhet som har til hensikt å fremme korrekt legemiddelhåndtering og bruk i befolkningen. Informasjonsformidling og veiledningsoppgaver må bli viktige sider ved apotekfarmasøytenes arbeids- og ansvarsområde.
4. Apotekene bør, i den grad det er nødvendig og forholdene ligger til rette for det, yte service også på felter innenfor helseområdet hvor apotekfunksjon ikke har monopolkarakter, blant annet når det gjelder vareområder som sykepleieartikler, forbindingssaker, handikaphjelpemidler o.l. og på felter som alminnelig helseopplysningsvirksomhet, analyse- og laboratorietjenester, førstehjelp mv.
5. Prisene på apotekenes ytelser må være ens over hele landet og så lave som mulig under hensyntagen til at et tilfredsstillende kvalitetsnivå skal opprettholdes. Ressursfordelingen mellom de ulike ledd innen legemiddelområdet må være rimelig i forhold til de oppgaver som skal skjøttes.»
Sosial- og helsedepartementet oppnevnte i 1996 et utvalg som gjerne omtales som Strømutvalget. Utvalget fikk mandat til å vurdere ulike modeller for omsetning av legemidler som «ivaretar de helsepolitiske målsettinger og samtidig medfører en mest mulig effektiv ressursutnyttelse». Som følge av Strømutvalgets anbefalinger (NOU 1997: 6 Rammevilkår for omsetning av legemidler), herunder anbefalinger om endringer i eierskapsbestemmelser med sikte på en mer markedsstyrt apoteketablering samt innføring av ordningen for generisk bytte i apotek for å stimulere til konkurranse om legemidlenes pris, fremmet regjeringen i 1998 i Ot.prp. nr. 29 (1998–99) Om lov om apotek (apotekloven) – Ny apoteklov som ledd i en samlet gjennomgang av legemiddelpolitikken forslag til ny apoteklov. Loven ble vedtatt av Stortinget i februar 2000, og trådte i kraft 1. mars 2001.
3.4 Situasjonen etter apotekreformen i 2001
3.4.1 Formål og målsettinger med apotekloven
Apoteklovens primære formål er å sikre forsvarlig utlevering av legemidler til sluttbrukere. Videre skal apotekene medvirke til riktig legemiddelbruk, god tilgjengelighet i alle deler av landet til legemidler og farmasøytiske tjenester som har god kvalitet og rimelig pris.
Apotekloven innførte ifølge St.meld. nr. 18 (2004–2005) Rett kurs mot riktigere legemiddelbruk to grunnleggende endringer på apotekområdet: (1) friere etablering og eierskap til apotek, og (2) adgang til å gjennomføre generisk bytte av legemidler i apotek.
Friere etableringsadgang skulle øke tilgjengeligheten til og servicen på apotektjenester, samt fremme kostnadseffektivisering. Tilgjengelighet og generisk bytte skulle stimulere til økt konkurranse mellom apotek og mellom legemiddelprodusenter og dermed bidra til lavere pris på legemidler og apotektjenester.
Tidligere var det myndighetene som bestemte både antall apotek og hvor apotekene skulle ligge. Nåværende apoteklov setter ingen begrensninger på antall eller hvor det skal opprettes apotek. Departementet kan imidlertid i forskrift fastsette regler som begrenser retten til apotekkonsesjon dersom hensynet til en geografisk forsvarlig fordeling av farmasøytisk personell tilsier det.
Kravet om at apotekets eier måtte ha farmasøytisk embetseksamen (nå master i farmasi eller tilsvarende), er også fjernet. Etter apotekloven kreves det konsesjon både for eierskap (apotekkonsesjon) og drift av apotek (driftskonsesjon). For å drive et apotek, stiller apotekloven fremdeles krav om at man har autorisasjon som provisorfarmasøyt, som innebærer master i farmasi eller tilsvarende, samt minst to års farmasøytisk praksis etter eksamen.
Det er også enkelte begrensninger i loven knyttet til hvem som kan eie apotek, for eksempel kan personer som har rekvireringsrett for legemidler, industrielle tilvirkere av legemidler og foretak som tar syke i behandling, ikke gis apotekkonsesjon. Eierskapsbegrensningsregelen er innført for å hindre uheldig innflytelse på apotekomsetningen.
Ordningen med adgang til å gjennomføre generisk bytte av legemidler i apotek innebærer at pasienter kan få utlevert et annet legemiddel enn det legen har rekvirert, men med samme virkestoff i samme styrke, forutsatt at det generiske eller biotilsvarende legemidlet er vurdert som medisinsk likeverdig og oppført på en særskilt bytteliste fastsatt av Legemiddelverket.
3.4.2 Endringer i markedet etter apotekloven av 2000
Den tradisjonelle forsyningskjeden for legemidler består av legemiddeltilvirker, legemiddelgrossist og detaljist (apotek), jf. kapittel 4.3 og 5.2. Antall apotek har økt betydelig etter 2001, fra 397 per 1. januar 2001 til om lag 1 045 apotek per 1. januar 2023. Flere apotek i hele landet, økt antall helsepersonell som er ansatt i apotek, og utvidete åpningstider gjennom etablering av apotek i kjøpesentre, har bidratt til økt tilgjengelighet for befolkningen. Det har i tillegg skjedd en horisontal og vertikal integrering i apotekleddet etter at gjeldende regelverk åpnet for at ett eller flere apotek kunne eies av foretak, eksempelvis foretak som også eier en legemiddelgrossist. Apotekene har i stor grad organisert seg horisontalt i tre dominerende apotekkjeder. Innen april 2002 var alle tre apotekkjeder gjennom eierskap vertikalt integrerte med hver sin legemiddelgrossist. Apotek og grossist er dermed en del av samme selskap. Apotekkjedene er alle eid av internasjonale selskaper som er involvert i virksomheter i legemiddelforsyningskjeden både i og til dels utenfor Europa.
I dag har om lag 94 prosent av apotekene i Norge tilknytning til en av kjedene, mens henholdsvis tre prosent er frittstående apotek uten kjedetilknytning og tre prosent er sykehusapotek. De frittstående apotekene er i stor grad organisert i frivillige innkjøpssamarbeid, men er ikke eierskapsmessig integrert med en apotekkjede. De fleste frittstående apotek som ikke er kjedetilknyttet, inngår i Apotekergruppen. Alle grossister som leverer legemidler til apotek og som også leverer et bredt sortiment av legemidler, er vertikalt integrert med en apotekkjede. Det er fri etablering av grossistvirksomhet, men grossister som leverer til apotek må som hovedregel innen 24 timer kunne levere hvor som helst i landet. Frittstående apotek kjøper derfor legemidler gjennom apotekkjedenes grossister.
Samhandlingen mellom kommunehelsetjenesten og apotekene dreide seg tradisjonelt om samarbeid mellom et sonekontor i hjemmesykepleietjenesten og det lokale apoteket. I dag er samhandling med den kommunale helse- og omsorgstjenesten i større grad enn tidligere sentralisert til noen få apotek.
Inntil 2003 var detaljomsetning av reseptfrie legemidler, med unntak for naturlegemidler, forbeholdt apotekene. I Sem-erklæringen la Kjell Magne Bondeviks andre regjering opp til å åpne for salg av reseptfrie legemidler utenom apotek. Med utgangspunkt i Legemiddelverkets utredning av 1. juli 2002, ble forslag til nødvendige forskriftsendringer sendt på høring 24. januar 2003. Forskrift 14. august 2003 nr. 1053 om omsetning mv. av visse reseptfrie legemidler utenom apotek (LUA-forskriften) trådte i kraft 1. november 2003.
3.4.3 Endringer i apotekloven etter 2001
I St.meld. nr. 18 (2004–2005) ble det varslet en gjennomgang av apotekloven, og Legemiddelverket fikk i oppdrag å gjennomgå apoteklovgivningen. Dette dannet grunnlag for forslag til endringer i apotekloven, som ble sendt på høring 29. oktober 2008. Forslag til endringer i forskrift 26. februar 2001 nr. 178 om apotek (apotekforskriften) inngikk i samme høringsnotat. Ot.prp. nr. 91 (2008–2009) Om lov om endringer i apotekloven ble fremmet på bakgrunn av høringen og inneholdt forslag til flere endringer av apotekloven. De viktigste forslagene var knyttet til bestemmelsen om forsendelse av legemidler og endringer knyttet til myndighetenes tilsyn. Departementet foreslo i proposisjonen blant annet:
Å erstatte prinsippet om forbud mot levering av legemidler ved forsendelse med at forsendelse er lov med mindre forsendelsesadgangen er begrenset i forskrift.
Å fastsette forskrifter som videreførte gjeldende forbud mot å sende reseptpliktige legemidler utenfor apotekets naturlige geografiske kundeområde.
Å fjerne forbudet mot forsendelse av reseptfrie legemidler utenfor apotekets naturlige geografiske kundeområde.
Å formalisere tilsynsmyndighetenes rett til stedlig tilsyn med apotekkonsesjonær og å presisere apotekkonsesjonærens plikt til medvirkning.
Å klargjøre at pålegg om retting kan rettes mot både apoteker og apotekkonsesjonær.
I Prop. 62 L (2018–2019) Endringer i apotekloven, legemiddelloven og folketrygdloven (overtredelsesgebyr) ble det fremmet forslag om overtredelsesgebyr. Lovendringen trådte i kraft 1. januar 2022 og innebærer at det kan fattes vedtak om overtredelsesgebyr ved brudd på meldeplikten om at annen farmasøyt har overtatt driften av apoteket, jf. apotekloven § 3-8 og § 9-6.
I Prop. 84 L (2020–2021) Endringer i legemiddelloven og apotekloven (bytte av biologiske legemidler i apotek) ble det fremmet forslag om endringer i apotekloven og legemiddelloven slik at legemiddelbytte (tidligere generisk bytte) ikke lenger skulle forbeholdes generiske og parallellimporterte legemidler. Forslaget innebar at det ble åpnet for at originale biologiske legemidler og deres biotilsvarende legemidler kan vurderes som byttbare, herunder at biotilsvarende legemidler til samme original (referanseprodukt) kan settes på byttelisten som byttbare med hverandre.
3.5 Legemiddelmeldingene
3.5.1 Nærmere om Legemiddelmeldingen 2005
Det fremgår av St.meld. nr. 18 (2004–2005) at hovedmålsettinger for Helse- og omsorgsdepartementet på legemiddelområdet var følgende:
Befolkningen skal ha tilgang til sikre og effektive legemidler uavhengig av betalingsevne.
Legemidler skal brukes riktig faglig og økonomisk.
Det skal være lavest mulig pris på legemidler.
Videre står det i meldingen:
«Tilgang til legemidler og lave legemiddelpriser er, på lik linje med blant annet ønsket om god forskrivningspraksis og oppfølging av pasientene, forutsetninger for at legemidler skal brukes riktig. Det er imidlertid den faktiske bruken av legemidlene som til slutt er avgjørende for pasientens helse og for god ressursanvendelse. Riktig legemiddelbruk er derfor departementets overordnede målsetting med legemiddelpolitikken.»
Bakgrunnen for meldingen var blant annet ønsket om en helhetlig gjennomgang av blåreseptordningen i tillegg til evaluering av apotekloven som trådte i kraft i 2001. På oppdrag fra Helse- og omsorgsdepartementet utførte ECON Analyse AS i 2003 og 2004 en evaluering av om målsettingen med apotekloven var oppfylt. I meldingen står det at
«Evalueringen konkluderer med at målene knyttet til mer tilgjengelig service og effektivisering av apoteknæringen er nådd. Apotekloven har imidlertid ikke hatt noen klar effekt på utsalgsprisene.»
I St.meld. nr. 18 (2004–2005) ble det foreslått en rekke tiltak for å følge opp de legemiddelpolitiske målene. Et av hovedtemaene i meldingen var å utvikle et mer effektivt refusjonssystem. Et varslet tiltak var at departementet ville gå gjennom apoteklovgivningen i detalj. Det var også klart uttrykt at apotekdekningen i distriktene skulle opprettholdes. En videreføring av driftsstøtteordningen ble foreslått som hovedvirkemiddel for å sikre dette. Samtidig ønsket departementet å fremme forslag om å tillate forsendelse fra apotek til forbrukere i hele landet, etter at nye krav til forsendelse av legemidler var utredet. Nivået på de gjeldende apotekavansesatser ble vurdert som tilstrekkelig høyt. Departementet ønsket å videreføre reguleringen av apotekenes maksimale innkjøpspris og utsalgspris, men ville vurdere å endre ulike bestanddeler i avansesatsene gradvis, slik at kronetilleggene ble økt i forhold til de prosentvise tilleggene.
3.5.2 Nærmere om Legemiddelmeldingen 2015
Ett av formålene med Meld. St. 28 (2014–2015) Legemiddelmeldingen – Riktig bruk – bedre helse var å oppdatere målene fra Legemiddelmeldingen i 2005 slik at de var mer i tråd med overordnede helsepolitiske mål. Hovedintensjonen bak de eksisterende målene skulle videreføres, samtidig som Solbergregjeringens intensjoner formulert i regjeringsplattformen skulle ivaretas. Regjeringen forslo følgende mål:
Sikre god kvalitet ved behandling med legemidler.
Legemidler skal ha lavest mulig pris.
Likeverdig og rask tilgang til effektive legemidler.
Legge til rette for forskning og innovasjon.
Helse- og omsorgskomiteen påpekte i Innst. 151 S (2015–2016) at de fire legemiddelpolitiske målene må ses i sammenheng i utøvelsen av legemiddelpolitikken.
En rekke tiltak for å følge opp de legemiddelpolitiske målsettingene ble foreslått i meldingen. Tiltak som berørte apotekområdet, var blant annet:
Utrede felles legemiddelliste.
Vurdere om oppstartsveiledning kan være en egnet tjeneste dersom forsøket med Medisinstart viste gode resultater.
Utrede muligheten for å innføre standardiserte veiledningstjenester som for eksempel veiledning fra apotekfarmasøyt til pasienter med astma og KOLS.
Utrede regulatoriske og organisatoriske endringer for å bedre kvaliteten på multidose.
Gjennomføre en informasjonskampanje om retur av ubrukte legemidler til apotek.
Foreta en gjennomgang og vurdering av trinnprisordningen og apotekenes avanse i løpet av 2016.
Utrede hvilke endringer i regelverket, herunder opphevelse av forbudet mot etterskuddsvise rabatter, som er nødvendig for å legge til rette for prisrabatter for legemidler som finansieres av folketrygden.
Utrede en ordning med farmasøytutlevering i apotek.
Mange av tiltakene hadde som mål å bidra til mer riktig legemiddelbruk, og flere av tiltakene anses som fulgt opp eller er under oppfølging. Eksempelvis skal gjennomføringen av Pasientens legemiddelliste tilgjengeliggjøre pasientens legemiddelopplysninger i én felles nasjonal oversikt.
I 2016 ble det innført en egen takst for inhalasjonsveiledning i apotek, jf. Prop. 1 S (2015–2016). Videre utprøves Medisinstart, en veiledningstjeneste i apotek for pasienter som starter med et nytt legemiddel til behandling av høyt blodtrykk, høyt kolesterol eller blodfortynnende legemidler, se kapittel 7.2.3. Som en del av programmet for Pasientens legemiddelliste, skal Direktoratet for e-helse innføre multidose i e-resept.
Legemiddelverket utredet farmasøytutlevering på oppdrag fra Helse- og omsorgsdepartementet. Som oppfølging av dette ble en ordning med reseptfrie legemidler med risikominimeringstiltak innført fra 1. januar 2018. Ordningen innebærer at apotekansatte gir ekstra informasjon i forbindelse med utleveringen av legemidlet. Sildenafil (Viagra Reseptfri) er det første legemidlet som ble godkjent som reseptfritt legemiddel med krav til veiledning og kom i salg i desember 2019.
Utredninger med formål om å oppnå lavest mulig pris, herunder gjennomgang og vurdering av apotekenes avanse og trinnprissystemet samt vurdering av endringer i regelverket som tilrettelegger for prisrabatter for legemidler som finansieres av folketrygden, ble igangsatt som planlagt i 2016, jf. Innst. 151 S (2015–2016). Apotekavansen ble vurdert på nytt i 2020.
3.6 Utvikling i teknologi og samhandling
St.meld. nr. 18 (2004–2005) omtaler en rekke tiltak som skal bidra til riktig legemiddelbruk. Innføringen av e-resept (elektroniske resepter) og utvikling av forskrivnings- og ekspedisjonsstøtte (FEST) er sentrale virkemidler. Legemiddelverket forvalter strukturert informasjon om legemidler gjennom FEST, og FEST er datagrunnlag og den primære kilden til informasjon om legemidler og refusjonsinformasjon i legenes journalsystem, apotekenes ekspedisjonssystem, e-resept, kjernejournal med videre. Legemiddelverket kan sende varsler med viktig informasjon direkte til legenes journalsystem via FEST. Apotekene bruker Farmaloggs vareregister, som utveksler data med blant annet Legemiddelverket og FEST.
E-resept ble i sin tid utviklet for å sikre elektronisk oppgjørsordning for refusjonslegemidler fra apotek. Løsningene for e-resept har bidratt til bedre informasjonsutveksling om reseptopplysninger mellom lege og apotek og gir pasienten god oversikt over gyldige resepter. Derimot har løsningen ikke funksjonalitet for kommunikasjon mellom lege og apotek rundt pasientens legemiddelbruk. Tall fra Direktoratet for e-helse viser at 93 prosent av all rekvirering av legemidler på resept til mennesker skjer elektronisk. Informasjon i Reseptformidleren danner grunnlag for informasjon i nasjonal kjernejournal. Nasjonal innføring av e-resept startet i alle landets apotek i 2012, se kapittel 8.3.5 for nærmere omtale.
Apotekaktørene har utviklet en ny felles kjerneløsning, Eik, som sammen med apotekenes egne forretningsløsninger, skal erstatte dagens apotekløsning (FarmaPro) i alle landets apotek. Eik er en samhandlingsplattform som gjør det mulig å dele pasientinformasjon på tvers av apotek og juridiske enheter.
Teknologi og samhandling beskrives mer inngående i kapittel 8.
3.7 Internettsalg av legemidler
Endringene i apotekloven i 2009 åpnet for forsendelse av reseptfrie legemidler over hele landet fra 1. januar 2010. Dermed ble det åpnet for salg av reseptfrie legemidler over internett. Helse- og omsorgsdepartementet fremmet i 2015 forslag om å oppheve begrensningene i apotekenes adgang til å sende reseptpliktige legemidler til forbrukere bosatt utenfor apotekets naturlige geografiske kundeområde, samt tilrettelegge for etablering av nettapotek som tilbød alle legemidler tillatt solgt i Norge. Samtidig foreslo man å innføre en aldersgrense på 18 år ved internettsalg av reseptfrie legemidler samt å innskrenke ordningen for refusjon av frakt. De foreslåtte endringene ble vedtatt og trådte i kraft fra 1. januar 2016. Videre la man til rette for at nettapotek kunne koble sine nettløsninger opp mot Reseptformidleren. De første nettapotekene som også selger reseptpliktige legemidler etablerte seg i oktober 2016. Det var per 1. januar 2022 i alt 15 registrerte nettapotek i Norge. «Klikk-og-hent» nettsalg kommer i tillegg.
3.8 Konsekvenser av deregulering – bakgrunnen for den foreliggende utredningen
Apotekmarkedet er i endring. Adgang til internettsalg har medført at en større andel av salg av legemidler skjer via nettapotek. I de senere år har det kommet ulike nye apotekformer, herunder nettapotek, apotek med salg via nettside og utlevering på fysisk apotek, samt bruk av nettapotek for levering av medisinsk forbruksmateriell og næringsmidler. Internettsalget av legemidler har hatt en betydelig vekst i de senere år, både i Norge og i andre europeiske land, hvor det angis vekstrater mellom 16 prosent (Italia) og opp mot 65 prosent (Spania) i perioden juni 2019 – juni 2020 (IQVIA, 2020a). Omsetningen via nettapotek i Norge er også i vekst, blant annet som følge av covid-19-pandemien. De norske nettapotekenes markedsandel er med om lag tre prosent imidlertid fortsatt lavere enn nettapotekenes markedsandeler i flere andre land, jf. kapittel 5.3.6.
Apotekloven fra 2001 er innrettet mot fysiske apotek, og loven er i liten grad tilpasset salg over internett. Enkeltbestemmelser som blant annet krav om at apotek skal være fysisk tilgjengelig for publikum og apotekenes leveringsplikt, ble vurdert både før og etter det ble åpnet for salg over internett. Apoteklovgivningen ble gjennomgått av Legemiddelverket i 2007, og gjennomgangen dannet grunnlaget for endringene i apotekloven i 2009. I Legemiddelverkets utredning drøftes kravet om fysisk tilgjengelighet av apotek.
For å foreta en helhetlig gjennomgang ga Helse- og omsorgsdepartementet i 2020 Legemiddelverket i oppdrag å utrede hvordan apotekregelverket bør innrettes for fremtiden, med sikte på at dette tilpasses dagens apotekmarked, hvor salg av legemidler skjer både i fysiske apotek og via nettapotek. I forbindelse med oppdraget ble det gjennomført en innspillsrunde. Basert på innspillene ble oppdraget i februar 2021 revidert. Helse- og omsorgsdepartementet påpekte blant annet at
«det er behov for å se endringer i en større sammenheng og vil igangsette en prosess for å se på apotekenes rolle og rammebetingelser, særlig sett i lys av utviklingen av nettapotek. Det opprinnelige oppdraget om å utrede endringer i apotekregelverket knyttet til nettapotek, justeres derfor til at Legemiddelverket skal levere en oppsummering av innspill mottatt fra aktørene samt Legemiddelverkets vurdering av innspillenes egnethet for videre utredning. Legemiddelverkets innspill vil være utgangspunkt for den videre prosessen.»
Mottatte innspill tydeliggjorde behovet for å utrede enkelte problemstillinger nærmere. Dette gjelder blant annet hvordan økt salg via nettapotek vil påvirke tilgangen til apotektjenester, konsekvenser av ulike måter å regulere leveringsplikten og hvorvidt nettapotek skal ha samme leveringsplikt som fysiske apotek. Like krav til alle aktører vil sikre at ingen aktører kan velge bort varer med lav lønnsomhet, men det ble påpekt at man samtidig må sikre at det ikke settes uforholdsmessig høye priser på frakt av ulønnsomme varer. Om flere lokale apotek legges ned som følge av økt nettsalg, kan videreføring av dagens differensiering av leveringsplikten på sikt gi dårligere tilgjengelighet til apotektjenester.
Legemiddelverket mente også at det å fjerne kravet om at apotek må være fysisk tilgjengelig for publikum, avstedkommer en del nye problemstillinger. Dette gjelder for eksempel spørsmålet om departementet skal tillate drift av et apotek på flere lokasjoner og foreta elektronisk farmasøytkontroll fra et annet sted enn der legemidlene tilvirkes, lagres, istandgjøres, og pakkes.
Legemiddelverkets svar på oppdraget, samt tidligere funn med hensyn til konkurranse i markedet og legemiddelpolitisk måloppnåelse om lavest mulig pris, ble lagt til grunn ved utarbeidelse av mandatet for dette utvalget. Før mandatet ble ferdigstilt, gjennomførte departementet et innspillsmøte med relevante aktører etterfulgt av en skriftlig innspillsrunde.
4 Gjeldende rett
4.1 Innledning
Ifølge mandatet skal utvalget vurdere regelverk som knytter seg til apotekvirksomhet. Utredningen omfatter apotekvirksomhet generelt, men utvalget skal spesielt vurdere behovet for reguleringer som skal legge til rette for økt konkurranse og nye apotekløsninger. I forlengelsen av dette viser mandatet til at statens tredjepartsfinansiering av utgifter til legemidler medfører at det ikke er sterk priskonkurranse mellom apotek ved salg av reseptpliktige legemidler til sluttbruker. For å nå målet om lavest mulig pris, regulerer staten prisen på legemidler.
Mandatet fremhever også at god samhandling mellom helsepersonell i apotek og annet helsepersonell samt med andre deler av helsetjenesten, er en forutsetning for god pasientbehandling og for at legemidler utleveres og brukes riktig. I den forbindelse er utvalget bedt om å peke på eventuelle begrensninger i regelverket som vanskeliggjør effektiv samhandling mellom apotek og andre aktører i helsetjenesten og foreslå endringer som utvalget finner nødvendig.
4.2 Om regelverket for legemidler
Med legemiddel forstås stoffer, droger og preparater som er bestemt til eller utgis for å brukes til å forebygge, lege eller lindre sykdom, sykdomssymptomer eller smerter, påvirke fysiologiske funksjoner hos mennesker eller dyr, eller til innvortes eller utvortes bruk for å påvise sykdom, jf. lov 4. desember 1992 nr. 132 (legemiddelloven) § 2. Stoffer, droger og preparater kan omfattes av definisjonene enten fordi de etter sitt innhold har slike egenskaper som angitt i definisjonen, eller fordi de påstås å ha slike egenskaper.
I det følgende beskrives regelverket for legemidler til mennesker. Både dette regelverket og regelverket for legemidler til dyr er langt på vei totalharmonisert i EØS. Legemidler til dyr reguleres av legemiddelloven kapittel I a med tilhørende forskrifter. Forordning (EU) 2019/6 om legemidler til dyr gjelder som norsk lov, jf. legemiddelloven § 2 b. Regelverket for legemidler til dyr har store fellestrekk med regelverket for legemidler til mennesker, men det er også noen forskjeller, blant annet fordi dyr inngår i matproduksjon, jf. Prop. 102 LS (2021–2022) Endringer i legemiddelloven (legemidler til dyr) og samtykke til godkjenning av EØS-komiteens beslutning nr. 371/2021 om innlemmelse i EØS-avtalen av forordning (EU) 2019/6 om legemidler til dyr side 8.
Industrielt tilvirkede legemidler må ha markedsføringstillatelse før de omsettes, jf. legemiddelloven § 8. Søknad skal vedlegges dokumentasjon av legemidlets kvalitet, sikkerhet og effekt. Legemidler som ikke er industrielt tilvirket, eksempelvis legemidler som er tilvirket i apotek, kan selges uten markedsføringstillatelse, jf. forskrift 18. desember 2009 nr. 1839 om legemidler til mennesker (legemiddelforskriften) § 2-2.
Søknad om markedsføringstillatelse behandles enten rent nasjonalt av Legemiddelverket eller av flere land i felleskap i ulike samarbeidsprosedyrer, se omtale i Prop. 102 LS (2021–2022) kapittel 13. Prosedyrene omtales som nasjonal prosedyre, desentralisert prosedyre, gjensidig anerkjennelsesprosedyre og sentral prosedyre, jf. legemiddelforskriften § 3-1. Søknad om markedsføringstillatelse skal behandles i løpet av 210 dager, jf. legemiddelforskriften § 5-3. I sentral prosedyre er det EU-kommisjonen som utsteder markedsføringstillatelse som gjelder for EU-landene. I slike tilfeller fatter Legemiddelverket tilsvarende vedtak som EU-kommisjonen, innen 30 dager, jf. legemiddelforskriften § 6-1 åttende ledd.
Når markedsføringstillatelse er gitt, har innehaveren av markedsføringstillatelsen et ansvar for å overvåke legemidlet slik at eventuelle nye bivirkninger oppdages, jf. legemiddelforskriften § 8-5 og kapittel 10 a.
For generiske og biotilsvarende legemidler må det også søkes om markedsføringstillatelse, men kravene til dokumentasjon er mindre omfattende enn for originallegemidlet. Generiske og biotilsvarende legemidler kan plasseres på markedet når originallegemidlets patent- og markedsbeskyttelse er utløpt. Patentbeskyttelse for legemidler løper fra den dagen søknaden om patent ble innsendt og gjelder i 20 år. For legemidler kan det også søkes om et supplerende beskyttelsessertifikat som maksimalt kan gi fem og et halvt år ekstra beskyttelse. Samlet beskyttelsestid kan derfor maksimalt være 25 og et halvt år, jf. lov 15. desember 1967 nr. 9 om patenter (patentloven) kapittel 9 a.
Det tar ofte lang tid å utvikle et legemiddel, og det kan derfor i noen tilfeller være begrenset patentbeskyttelse igjen når legemidlet får markedsføringstillatelse. Legemiddelregelverket har derfor regler om markedsbeskyttelse som innebærer at ingen generiske eller biotilsvarende legemidler kan markedsføres før det har gått minst ti år siden originallegemidlet fikk sin første markedsføringstillatelse i EØS-området, jf. legemiddelforskriften § 3-10 til og med 3-11 d.
Legemidler uten norsk markedsføringstillatelse kan gjøres tilgjengelig for pasient, rekvirentens praksis, sykehus eller poliklinikk etter søknad om godkjenningsfritak, jf. legemiddelforskriften § 2-5 og forskrift 8. september 2022 nr. 1573 om legemidler til dyr (forskrift om legemidler til dyr) kapittel IV.
Regelverket for medisinsk utstyr
Regelverket for medisinsk utstyr er fullharmonisert i EØS. Medisinsk utstyr reguleres av forordning (EU) 2017/745 om medisinsk utstyr og forordning (EU) 2017/746 om in vitro-diagnostisk medisinsk utstyr som gjelder som norsk lov, jf. lov 7. mai 2020 nr. 37 om medisinsk utstyr § 1. Mens legemidler godkjennes av legemiddelmyndighetene etter søknad om markedsføringstillatelse, plasseres medisinsk utstyr på markedet basert på produsentenes egen vurdering av at produktet oppfyller kravene i regelverket. En slik samsvarsvurdering innebærer en vurdering av et medisinsk utstyr der hensikten er at produsenten skal dokumentere overensstemmelse med de grunnleggende kravene i prosedyrene som er angitt i regelverket.
For medisinsk utstyr i høyere risikoklasser (klasse IIa, IIb og III for medisinsk utstyr og klasse B, C og D for IVD-utstyr) må produktet og produsentens dokumentasjon vurderes av et meldt organ/teknisk kontrollorgan før utstyret kan settes på markedet. Kravet til involvering av meldt organ/teknisk kontrollorgan gjelder også for utstyr i klasse I som leveres sterilt (klasse Is), har en målefunksjon (klasse Im) eller er gjenbrukbart kirurgisk utstyr (klasse Ir). Tilsvarende må meldt organ/teknisk kontrollorgan involveres i samsvarsvurderingen av IVD-utstyr i klasse A som leveres sterilt. Produkter i den laveste risikoklassen (klasse I for medisinsk utstyr og klasse A for IVD-utstyr) vurderes av produsenten uten involvering av meldt organ/teknisk kontrollorgan.
4.3 Forsyningskjeden for legemidler
4.3.1 Aktører i forsyningskjeden
Forsyningskjeden for legemidler består av ulike aktører som tilvirkere av virkestoff, tilvirkere av legemidler, importører, legemiddelformidlere, legemiddelgrossister og detaljister, herunder apotek. Aktørene, med noen unntak, har det til felles at de må godkjenne eller registrere sin virksomhet hos Legemiddelverket, se omtale nedenfor.
4.3.2 Tilvirkere og innehavere av markedsføringstillatelse
Tilvirkere av aktive virkestoff (heretter virkestoff) og av bruksferdige legemidler (heretter legemidler) må ha godkjenning fra Legemiddelverket, jf. legemiddelloven § 2 b, § 12 og forskrift 2. november 2004 nr. 1441 om tilvirkning og import av legemidler (tilvirkningsforskriften) § 2-1. Tilvirkning av legemidler må skje i henhold til standarden for god tilvirkningspraksis (GMP), se legemiddelloven § 2 b, jf. forordning (EU) 2019/6 artikkel 93, og tilvirkningsforskriften § 2-8, som gjennomfører direktiv 2003/94/EF om prinsipper og retningslinjer for god tilvirkningspraksis for legemidler til mennesker i norsk rett. Import av legemidler fra land utenfor EØS krever også tilvirkertillatelse, jf. legemiddelloven § 2 b, jf. forordning (EU) 2019/6 artikkel 88 nr. 1, og legemiddelloven § 13. Tilvirkere og importører kan i medhold av legemiddelloven § 14 annet ledd drive grossistomsetning av de legemidler som tilvirker- eller importgodkjenningen gjelder for. Se også forordning (EU) 2019/6 artikkel 99 nr. 5. De kan også levere legemidlene til apotek.
For tilvirkning i apotek eller på oppdrag for apotek gis tilvirkertillatelse i henhold til bestemmelsene i apotekloven kapittel 7 og i forskrift 26. juni 2001 nr. 738 om tilvirkning av legemidler i apotek.
4.3.3 Grossister
Grossistvirksomhet med legemidler krever tillatelse, jf. legemiddelloven § 2 b, jf. forordning (EU) 2019/6 artikkel 99 og legemiddelloven § 14. Slik virksomhet er i loven definert som «all virksomhet som går ut på anskaffelse, oppbevaring, utlevering eller eksport av legemidler, med unntak for utlevering av legemidler til allmennheten». Grossisttillatelse gis av Legemiddelverket i henhold til bestemmelsene i forskrift 21. desember 1993 nr. 1219 om grossistvirksomhet med legemidler (grossistforskriften). Legemiddelgrossister er etter forskriften pålagt plikter som å beredskapssikre et ekstra lager av legemidler, og det stilles krav til personell, utstyr og lager, krav til dokumentasjon og rapportering med videre. Virksomheten skal foregå etter sikre og dokumenterbare arbeidsrutiner som er i overensstemmelse med retningslinjer for god distribusjonspraksis (GDP) utgitt av EU-kommisjonen (Europakommisjonen, 2013), jf. grossistforskriften § 9 og forskrift om legemidler til dyr § 1-4. GDP stiller krav til kvalitetssystem, rutiner for kjøp, salg, lagring, sporing og tilbakekalling av legemidler med videre. Fra 2013 ble det innført felleseuropeisk regelverk for å hindre falske legemidler i forsyningskjeden, jf. direktiv 2011/62/EU. Regelverket omfatter alle ledd i forsyningskjeden, herunder legemiddelgrossistene. Implementering av regelverket ble fullført ved innføringen av legemiddelverifiseringssystemet i 2019, se kapittel 4.3.5.
Legemidler som kjøpes inn av apotek, skal som hovedregel bare leveres fra godkjent grossist eller fra annen virksomhet som har departementets tillatelse til å selge legemidler til apotek, jf. apotekloven § 5-4. Tidligere måtte grossister som leverte legemidler til apotek, føre det utvalg av legemidler som ble etterspurt i det norske marked. Dette ble omtalt som fullsortimentskravet. Fullsortimentskravet ble opphevet 2. januar 2015. Endringen må ses i sammenheng med Stortingets behandling av Ot.prp. nr. 91 (2008–2009), hvor Helse- og omsorgskomitéen samlet uttalte at de ønsket fullsortimentskravet fjernet for å fremme konkurranse i markedet:
«Slik komiteen ser det, fører dagens struktur med vertikal integrasjon mellom grossist- og detaljistledd til svak konkurranse i markedet (…). Dagens krav til fullsortiment i grossistleddet bør etter komiteens vurdering avskaffes for å bidra til mer effektive distribusjonsløsninger og etablering av nisjegrossister.»
Komiteens uttalelse ble fulgt opp blant annet gjennom Legemiddelverkets konsekvensanalyse av å oppheve fullsortimentskravet, og et forslag om å fjerne kravet ble sendt på høring 19. april 2012. Av høringen fremgikk det at blant annet apotekkjedene, Apotekforeningen og Norges Farmaceutiske Forening var mot å oppheve fullsortimentskravet. Det ble blant annet fremholdt at opphevelsen kunne medføre merkostnader for apotek som eventuelt måtte forholde seg til flere grossister. Legemiddelindustriforeningen (nå Legemiddelindustrien) og Konkurransetilsynet hadde forut for høringen støttet forslaget. Deres synspunkter oppsummeres slik etter høringen:
«Legemiddelindustriforeningen og Konkurransetilsynet står fast på sine tidligere synspunkter om at fullsortimentskravet bør oppheves for å stimulere til økt konkurranse, og at dette ikke vil få negative konsekvenser for viktige legemiddelpolitiske målsetninger. Konkurransetilsynet mener at fullsortimentskravet utgjør en betydelig etableringsbarriere, fordi det stenger for nye grossister som bare vil distribuere et utvalg av legemidler til markedet. Økt konkurranse i grossistleddet vil også kunne bedre konkurransesituasjon i apotekleddet. I dag må uavhengige apotek få sine forsyninger via konkurrerende apotekkjeder. I tillegg vil etablering av flere grossister kunne øke konkurransen blant leverandører av generiske legemidler.»
Etter at fullsortimentskravet ble opphevet, er grossistene ikke lenger pålagt krav om å føre det utvalg av legemidler som etterspørres i det norske marked. I stedet har grossister som leverer til apotek, leveringsplikt for alle legemidler som grossisten fører, jf. grossistforskriften § 4 første ledd. Grossisten må kunne levere hvor som helst i landet innen 24 timer, men det gjelder et unntak for områder med vanskelige kommunikasjonsforhold hvor leveranse som hovedregel skal skje innen 48 timer. Dette kravet gjelder også for importører og tilvirkere av legemidler som i medhold av disse tillatelsene velger å levere sine legemidler til apotek, jf. legemiddelloven § 14 annet ledd.
Grossister er i grossistforskriften kapittel V pålagt å melde opplysninger om sin omsetning av legemidler til Folkehelseinstituttet. Formålet med bestemmelsene er å kartlegge legemiddelomsetningen i landet over tid slik at man får en oversikt over det totale legemiddelsalget til bruk for forskning på legemiddelområdet og for helsemyndighetenes overordnede planlegging og styring av legemiddelforsyningen, jf. grossistforskriften § 18 og § 24. Grossistene skal blant annet rapportere opplysninger om beregnet netto innkjøpspris for grossist og apotek. Kravet om å rapportere nettopriser må ses i sammenheng med legemiddelloven § 6 annet ledd, som gjerne omtales som forbudet mot annet enn samtidige rabatter:
«Det er forbudt å gi rabatter som ikke er fastlagt på tidspunktet for salget av et legemiddel. Forbudet gjelder ikke rabatter som følger av avtale mellom det offentlige og legemidlets rettighetshaver for å sikre offentlig finansiering av legemidlet.»
Forbudet kom inn i loven etter forslag fra Helsedepartementet i Ot.prp. nr. 16 (2002–2003) Om lov om endringer i legemiddelloven og apotekloven (konkurransestimulerende tiltak i markedet for generiske legemidler) i anledning innføringen av det såkalte indeksprissystemet.
Vertikal og horisontal integrasjon er nærmere omtalt i kapittel 6.2.2.
4.3.4 Legemiddelformidlere
Legemiddelformidlere anses som en del av legemiddelforsyningskjeden. Med legemiddelformidling menes enhver form for virksomhet knyttet til salg eller kjøp av legemidler, unntatt grossist- og detaljomsetning, som ikke innebærer fysisk håndtering, og som består i å forhandle uavhengig og på vegne av en annen juridisk eller fysisk person, jf. legemiddelforskriften § 15a. Sykehusinnkjøp HF er en slik formidler. Legemiddelformidlere som har adresse i Norge, må være registrert i et offentlig tilgjengelig register hos Legemiddelverket for å kunne formidle legemidler innenfor EU/EØS-området, jf. grossistforskriften § 33a. Kravet om registrering gjelder bare for aktører som formidler legemidler til mennesker. Det er i dag registrert tolv slike formidlere i Norge.
Krav til legemiddelformidlere ble vedtatt i EU gjennom direktiv 2011/62/EU, som skal bidra til å forhindre at forfalskede legemidler får tilgang til den lovlige forsyningskjeden for legemidler. Det ble lagt til grunn at det hadde skjedd en alarmerende økning av antallet forfalskede legemidler i EU, herunder forfalskninger av innovative og livreddende legemidler. Slike legemidler viste seg å ha blitt kanalisert gjennom den lovlige forsyningskjeden. I 2007 ble det i EU-sammenheng antatt at flere tusen pakker med forfalskede legemidler hadde nådd frem til pasienter.
4.3.5 Legemiddelverifiseringssystemet
I Norge har det vært noen få kjente tilfeller av forfalskede legemidler i den lovlige legemiddelforsyningskjeden før innføring av direktiv 2011/62/EU (Røset, 2014). Innføringen av direktivet medførte opprettelsen av The Medicines Verification System (Legemiddelverifiseringssystemet), som er et pan-europeisk system som skal sikre at forfalskede legemidler ikke kommer inn i den lovlige forsyningskjeden (Nomvec, u.å.).
Forordning (EU) 2016/161 som i henhold til legemiddelforskriften § 3-29 niende ledd gjelder som norsk forskrift, legger ansvaret for finansiering og etablering av det pan-europeiske systemet til legemiddelprodusentene. Legemiddelverifiseringssystemet består av en sentral del, etablert av en europeisk organisasjon, European Medicines Verification Organisation (EMVO), og tilknyttede nasjonale databaser i hvert land. Til sammen utgjør dette et nettverk som kobler sammen produsenter via EMVO, med sluttbrukere som grossister, apotek og sykehus tilkoblet de nasjonale databasene. Dette gjør det mulig for eksempelvis et apotek i Norge å kontrollere at hver enkelt pakning er ekteprodusert, salgbar og levert til et europeisk marked.
I Norge er det organisasjonen Norwegian Medicines Verification Organisation (NoMVO), der Apotekforeningen, Legemiddelgrossistforeningen, Parallellimportørforeningen, Farma Norge og Legemiddelindustrien (LMI) er medlemmer, som treffer beslutninger knyttet til implementering, forvaltning og drift av systemet. Norwegian Medicines Verification Company (Nomvec AS) er et heleid datterselskap av LMI, som eier den norske databasen, som kobler opp nasjonale brukere, og som driver den økonomiske forvaltningen som kreves i Norge.
Ifølge forskrift 2. juni 2022 nr. 977 om rekvirering og utlevering av legemidler m.m. (forskrift om rekvirering og utlevering av legemidler m.m.) § 13-1 må norske apotek kontrollere alle legemiddelpakninger før de utleveres. Før utlevering til pasient og helse- og omsorgstjeneste sjekker apoteket forseglingen og skanner sikkerhetskoden for å melde pakningen ut av systemet, og kontrollerer at den ikke har vært utlevert allerede.
4.3.6 Detaljomsetning fra andre enn apotek
Med detaljomsetning menes salg av legemidler til allmennheten, herunder helseinstitusjoner eller andre brukere av legemidler, jf. legemiddelloven § 16 første ledd. Av bestemmelsens annet ledd følger at slik detaljomsetning skal bare forestås av apotek og medisinutsalg underlagt et apotek. Apotek omtales nærmere i kapittel 4.4, 5.2.4 og 7.
Unntak fra apotekenes enerett kan imidlertid fremgå av legemiddelloven eller forskrifter fastsatt med hjemmel i legemiddelloven.
Et slikt unntak fra apotekenes enerett følger av legemiddelloven § 16 fjerde ledd. Med hjemmel i bestemmelsen har Helse- og omsorgsdepartementet fastsatt LUA-forskriften. Det fremkommer at legemidlene kan omsettes fra virksomheter som omsetter næringsmidler. Det er ikke krav om at virksomheten skal godkjennes av Legemiddelverket, men ved salg av legemidler over internett må virksomheten opplyse Legemiddelverket om dette, jf. LUA-forskriften § 10 a. Siden virksomheter som omsetter næringsmidler normalt ikke har nødvendig kunnskap om legemidler, fremkommer det av forskriften at utsalgsstedets personale ikke skal gi muntlig informasjon om valg av legemiddel eller om legemidlenes egenskaper og bruk. Ved slikt behov skal kunden henvises til lege, apotek eller veiledningen på eller i legemidlets pakning. Legemiddelverket kan likevel etter søknad tillate at farmasøyt veileder utsalgets kunder om legemidlene.
Legemiddelverket fastsetter en liste over legemidler som kan selges utenom apotek, jf. LUA-forskriften § 1 første ledd bokstav a og § 6. Ved fastsettelsen av listen skal det tas hensyn til om det er særlig behov for enkel tilgang til veiledning fra farmasøyt. I så fall taler dette for at legemidlet ikke skal omsettes utenom apotek. I tillegg til legemidlene på listen, kan naturlegemidler, tradisjonelt plantebaserte legemidler, legemidler med innhold av nikotin til bruk ved røykeavvenning og homøopatiske legemidler selges utenom apotek.
Også legemiddelgrossister kan i noen grad drive detaljomsetning av legemidler. I utgangspunktet kan grossister bare utlevere legemidler til andre grossister, tilvirkere, importører eller til personer eller virksomhet som driver med detaljomsetning, jf. legemiddelloven § 15 annet ledd. Grossistene driver i slike tilfeller med grossistvirksomhet, og ikke med detaljomsetning. Grossister kan imidlertid utlevere legemidler til profesjonelle sluttbrukere etter nærmere bestemmelser gitt av departementet, jf. legemiddelloven § 2 d bokstav f og § 15 tredje ledd. Slike regler er gitt i grossistforskriften § 13 og i forskrift om legemidler til dyr § 9-5 bokstav g og h. Grossister kan selge legemidler blant annet til sykehjem som inngår i den kommunale helse- og omsorgstjenesten, til sykehus og til dyreeier. I sistnevnte tilfelle skal legemidlene utleveres til person med rekvireringsrett for legemidlene, som i praksis vil være veterinær eller fiskehelsebiolog. Ved grossisters detaljomsetning av legemidler til sykehjem, bestemmer grossistforskriften § 14 at forskrift om rekvirering og utlevering av legemidler m.m. gjelder tilsvarende.
Legemiddelloven § 17 åpner blant annet også for at leger, tannleger og veterinærer kan gis tillatelse til å levere legemidler, forbindingssaker og andre sykepleieartikler mot betaling når adgangen til apotek er tungvint. Legemidlene skal være anskaffet fra apoteket i ferdig tilberedt stand, se forskrifter 17. mars 1976 nr. 9444 om legers og veterinærers levering av legemidler m.v. mot betaling.
Som nevnt krever import av legemidler til Norge tilvirker- eller grossisttillatelse. Etter legemiddelloven § 13 sjette ledd kan det imidlertid i forskrift gis bestemmelser som gir privatpersoner rett til import av legemidler til eget bruk, uten at det kreves slike tillatelser som nevnt over. Slike bestemmelser er gitt i tilvirkningsforskriften § 3-2. Privatpersoner over 18 år kan privatimportere reseptfrie legemidler ved forsendelse fra annet EØS-land. Vedkommende må imidlertid kunne dokumentere at legemidlene er til personlig bruk og lovlig ervervet i innkjøpslandet. Forsendelsen må være vedlagt dokumentasjon som viser at selger lovlig kan selge og eksportere de aktuelle legemidlene, og at legemidlene har markedsføringstillatelse i Norge. Gitt at disse vilkårene er oppfylt, vil eksempelvis utenlandske apotek i EØS-området kunne drive forsendelse av reseptfrie legemidler til personer bosatt i Norge.
4.3.7 Sluttbrukere
Apotekloven definerer apotek som et salgssted for legemidler til sluttbruker hvor det gis legemiddelfaglig veiledning, som er fysisk tilgjengelig for publikum.
Av forarbeidene fremkommer det at sluttbruker skal forstås som «publikum, herunder helseinstitusjoner, sykehus og andre brukere av legemidler, jf. legemiddelloven § 16 første ledd», jf. Ot.prp. nr. 29 (1998–99), merknadene til apotekloven § 7-3. Sluttbrukere omfatter derfor både enkeltpersoner og profesjonelle sluttbrukere av legemidler. Eksempler på sistnevnte fremkommer av legemiddelloven § 15 tredje ledd, som bestemmer at grossister kan «(…) utlevere legemidler til profesjonelle sluttbrukere som sykehus, lege- og tannlegekontorer, offentlige og offentlig godkjente helseinstitusjoner, laboratorier og vitenskapelige institusjoner og andre lignende institusjoner eller bedrifter, etter nærmere bestemmelser av departementet».
4.4 Apotekloven
4.4.1 Formålene med apotekloven
Det fremgår av apoteklovens formålsbestemmelse at apotek skal sikre forsvarlig utlevering av legemidler til sluttbrukere, jf. § 1-1. Videre skal apotek medvirke til riktig legemiddelbruk i befolkningen og til god tilgjengelighet til legemidler og farmasøytiske tjenester i alle deler av landet. Legemidlene og tjenestene skal ha god kvalitet og rimelig pris.
I Meld. St. 28 (2014–2015) kapittel 18.2 står det:
«Apotekene er en viktig kanal for informasjon til pasienter om riktig bruk av legemidler, regelverk for refusjon, egenandeler og generisk bytte. Apotekpersonalet veileder om bruk av reseptfrie legemidler og henviser ved behov til lege eller annet helsepersonell. Ved ekspedering av legemidler på resept gjør apoteket en vurdering av resepten for å fange opp eventuelle feil og sikre at legemidlene utleveres i tråd med legens forskrivning.»
Apotekenes rolle for å sikre god kvalitet i legemiddelbehandlingen omtales nærmere i kapittel 7.2.
4.4.2 Eier- og driftskonsesjon
Bakgrunn
Som det fremgår av mandatet, åpnet gjeldende apoteklov for at grossister kan eie apotek, med den følge at tre vertikalt integrerte apotekkjeder har etablert seg i Norge. Ifølge mandatet skal utvalget vurdere om gjeldende regler om konsesjon til eierskap til apotek, og om den etablerte kjedestrukturen bidrar til å begrense konkurransen og etableringen av nye apotek og apotekformer.
For å eie og drive apotek kreves offentlig godkjenning i form av konsesjon til eierskap til apoteket (apotekkonsesjon) og konsesjon til drift av apoteket (driftskonsesjon), jf. apotekloven § 1-4. Apotekloven av 2000 innførte en friere regulering av etablering og eierskap i apotek. Mens det tidligere var myndighetene som bestemte både antall apotek og hvor apotekene skulle ligge, setter gjeldende apoteklov ingen begrensning på antallet eller beliggenheten for apotek.
Rett til driftskonsesjon
Rett til driftskonsesjon har søkere som har autorisasjon som provisorfarmasøyt, jf. apotekloven § 3-2. I tillegg må søkeren ha minst to års farmasøytisk praksis etter eksamen, hvorav minst tolv måneder ved apotek fra EØS-området eller Sveits. Apotekpraksis fra annet land kan legges til grunn dersom den vurderes som relevant for norske forhold. Videre stilles det krav om at søker har hederlig vandel i henhold til politiattest, at vedkommende skal være daglig leder for apoteket og før øvrig ikke anses uskikket til å drive apotek. Innehaver av driftskonsesjon er i apotekloven omtalt som apoteker, jf. apotekloven § 1-3 bokstav f. Driftskonsesjonærens ansvar og oppgaver, samt forholdet mellom driftskonsesjonær og apotekkonsesjonær er det redegjort for i kapittel 7.3.2.
Grunnkrav for å kunne eie apotek
For at søker skal ha rett til apotekkonsesjon, må vedkommende oppfylle to grunnvilkår. Første grunnvilkår er at søkeren må dokumentere økonomisk evne til å drive faglig forsvarlig i samsvar med krav til apotekvirksomhet fastsatt i lov og forskrift og også økonomisk evne til å tilby nødvendige ikke-lønnsomme farmasøytiske tjenester. Bestemmelsen skal bidra til at legemiddelforsyningen ikke settes i fare grunnet svakt økonomisk grunnlag for driften. I tillegg må søkeren kunne sannsynliggjøre at apotekets faglige virksomhet får et omfang som er stort nok til at apotekets kompetanse som faghandel og tilvirker av legemidler sikres og holdes ved like. Det siste vilkåret kan dokumenteres i fellesskap med annet eller andre nærliggende apotek med samme eier, eller i forpliktende samarbeid, jf. apotekloven § 2-2 første ledd. I tillegg må søkeren ikke være omfattet av bestemmelser om hvilke søkere som ikke kan gis apotekkonsesjon, se nærmere beskrivelse nedenfor.
Konkurransepolitiske hensyn og hensynet til en geografisk forsvarlig fordeling av farmasøytisk personell
Søkers rettskrav på apotekkonsesjon kan begrenses ved forskrift dersom konkurransepolitiske hensyn eller hensynet til en geografisk forsvarlig fordeling av farmasøytisk personell tilsier dette, se apotekloven § 2-2 annet og tredje ledd. Bestemmelsen ble foreslått av Sosialkomiteen ved behandlingen av forslaget til apotekloven av 2000, jf. Innst. O. nr. 52 (1999–2000) side 25. Hensikten var å hindre at én eier eller kjede får en for dominerende stilling i markedet.
Apotekforskriften § 13 åpnet tidligere for at myndighetene kunne nekte å gi apotekkonsesjon til foretak som har en markedsandel, alene eller sammen med tilknyttede foretak, på over 40 prosent, dersom hensynet til fungerende konkurranse tilsa dette. Bestemmelsen ble opphevet i 2020. I høringen ble det vist til at hjemmelen aldri var blitt benyttet. Konkurransetilsynet uttalte i brev av 19. august 2019 at apotekforskriften § 13 var egnet til å hemme konkurransen i apotekmarkedet. I høringen av forslag om opphevelse av bestemmelsen uttalte departementet:
«Dersom en aktør blir nektet apotekkonsesjon fordi den har oppnådd en for høy markedsandel, betyr det i praksis at den ikke kan vokse ytterligere, noe som vil svekke aktørens insentiv til å konkurrere. Dette vil i så fall også kunne svekke de øvrige aktørenes insentiv til å vinne kunder gjennom å tilby lengre åpningstider, bedre service, eller lavere priser, fordi de møter en mindre aggressiv konkurrent. I praksis vil derfor en restriksjon på markedsandel føre til at konkurransen i markedet begrenses, hvilket igjen vil kunne føre til dårligere betingelser for apotekkundene. Dette er etter departementets syn uheldig for kundene.
Et foretak som dominerer et marked, kan både ha insentiver og muligheter til å gjøre det vanskelig for konkurrenter å konkurrere effektivt. Det kan følgelig være behov for å begrense de negative virkningene av at en aktør blir for dominant i markedet. Konkurranseloven har bestemmelser som er ment å ivareta og fremme konkurransen i markedene. Eksempelvis er et foretaks utilbørlige utnyttelse av dominerende stilling i markedet forbudt etter lovens § 11. Konkurransetilsynet kan etter § 12 pålegge en aktør som bryter med bestemmelsen i § 11 å bringe overtredelsen til opphør. Vurdering av konkurransepolitiske hensyn er ikke blant Legemiddelverkets kjerneoppgaver, og det er etter departementets vurdering naturlig at det er Konkurransetilsynet som ivaretar dette hensynet også i apotekmarkedet, slik som i andre marked. Departementet mener således at den generelle konkurranselovgivningen er best egnet til å ivareta disse hensynene, og at det derfor ikke er behov for en egen bestemmelse om dette i apotekforskriften. Departementet foreslår på denne bakgrunn å oppheve apotekforskriften § 13.»
§ 13 ble opphevet ved forskrift 2. sept. 2020 nr. 1712.
Søkere som ikke kan gis apotekkonsesjon
Rettskrav på apotekkonsesjon begrenses også av apotekloven § 2-3 som bestemmer hvem som ikke kan gis apotekkonsesjon. Bestemmelsen innebærer at søknad om apotekkonsesjon skal avslås dersom vedkommende omfattes av bestemmelsen. Det er ikke adgang til å gjøre unntak. Bestemmelsen regulerer fysiske og juridiske personers rett til apotekkonsesjon, jf. henholdsvis § 2-3 første ledd bokstav a, og b til e.
Søkere som har rekvireringsrett for legemidler, er industriell tilvirker av legemidler eller er tilknyttet slik tilvirker eller foretak som tar syke i behandling, kan ikke gis apotekkonsesjon, jf. § 2-3 bokstav a. Bestemmelsen er blant annet begrunnet i behovet for å unngå at rekvirenter får økonomiske insentiver i sin rekvirering (forskrivning) av legemidler. I Ot.prp. nr. 61 (2000–2001) Om lov om endringer i apotekloven og legemiddelloven kapittel 2.1 heter det:
«Det er hensynet til et rasjonelt legemiddelforbruk som begrunner forbudet mot at forskrivere kan være økonomisk engasjert i apotekvirksomhet. Slikt engasjement ville gitt forskriveren et uheldig insentiv til å øke den økonomiske avkastningen ved økt forskrivning av legemidler. Hensynet slår til også på virksomhetsnivå. Hvis et selskap eier både apotek og et legesenter eller annet foretak som tar syke i behandling, vil konsernets inntjening øke hvis legesenteret øker sin forskrivning, gitt at reseptene blir kanalisert til konsernets apotek og legemidlene blir finansiert av enten kunden eller folketrygden.»
Etter gjeldende rett har blant annet leger, tannleger, farmasøyter, helsesykepleiere, sykepleiere, jordmødre, veterinærer, fiskehelsebiologer, tannpleiere og optikere rett til å rekvirere legemidler, jf. forskrift om rekvirering og utlevering av legemidler m.m. kapittel 3, 6 og 7. I forbindelse med at farmasøyter i 2020 ble gitt rett til å rekvirere bestemte vaksiner mot sesonginfluensa som skal administreres i apoteket, ble det samtidig bestemt at farmasøyter som eier apotek, ikke har slik rekvireringsrett. Denne bestemmelsen er videreført i ny forskrift om rekvirering og utlevering av legemidler m.m. § 7-2 første ledd. Fra 2021 har farmasøyter en midlertidig rett til å rekvirere vaksiner i henhold til vaksinasjonsprogram mot covid-19. Heller ikke for slike vaksiner har farmasøyter som eier apotek rekvireringsrett, jf. forskrift om rekvirering og utlevering av legemidler fra apotek § 7-2 tredje ledd.
Søkere som har slike nærstående, kan heller ikke gis apotekkonsesjon, jf § 2-3 bokstav a. Nærstående er definert i apotekforskriften § 10 som ektefelle og en person som vedkommende bor sammen med i ekteskapsliknende forhold, og slektninger i rett oppstigende eller nedstigende linje og søsken.
Foretak som ledes av person med rekvireringsrett, kan ikke gis apotekkonsesjon, jf. apotekloven § 2-3 bokstav b. Kravet gjelder for foretakets daglige leder, medlemmene av styret og deres nærstående, samt alle selskapsdeltakerne og deres nærstående hvis foretaket er et ansvarlig selskap. Departementet kan imidlertid gjøre unntak. Apotekkonsesjon kan heller ikke gis til foretak som direkte eller indirekte eies med ti prosent eller mer av person med rekvireringsrett for legemidler, jf. apotekloven § 2-3 bokstav c. Grensen gjelder tilsvarende for samarbeidende grupper av slike personer. Departementet kan imidlertid gjøre unntak der det er søkers nærstående som har rekvireringsrett.
Videre kan industrielle tilvirkere av legemidler ikke gis apotekkonsesjon, jf. apotekloven § 2-3 første ledd bokstav a. Dette omfatter også fysiske personer som driver industriell tilvirkning av legemidler. Forholdet er omtalt i St.meld. nr. 18 (2004–2005) side 70–71 hvor det fremgår at:
«Innehavere av markedsføringstillatelse for et legemiddel har de samme insentivene som industrielle tilvirkere av legemidlet til å oppnå høyest mulig pris for legemidlet. Innehaverens funksjon som representant for legemidlet skiller seg klart fra grossistfunksjonen og apotekfunksjonen (detaljist). Apotekkonsesjonærene kan derfor ikke inneha markedsføringstillatelse eller eies av noen som har slik tillatelse.»
Legemiddelverket har i forvaltningspraksis lagt til grunn at innehaver av markedsføringstillatelse for legemiddel er å anse som industriell tilvirker av legemidler, noe som også er stadfestet av Helse- og omsorgsdepartementet i sak 13/453. Bestemmelsen skal hindre at én aktør får kontroll over alle ledd i legemiddelforsyningskjeden, jf. Ot.prp. nr. 29 (1998–99) og merknadene til apotekloven § 2-3. Det samme gjelder der søkeren er tilknyttet slik tilvirker eller har slike nærstående.
Industriforetak som tilvirker legemidler, kan ikke gis apotekkonsesjon, jf. § 2-3 bokstav b. Også der søker kontrolleres av en eller flere industrielle tilvirkere av legemidler eller av foretak som direkte eller indirekte eier ti prosent eller mer av slike tilvirkere, kan vedkommende ikke innvilges apotekkonsesjon, jf. § 2-3 første ledd bokstav d. Etter apotekloven § 2-3 annet ledd har et foretak kontroll over et annet foretak når det tar plass før dette i en ubrutt rekke av foretak som har bestemmende innflytelse over en blokkerende minoritetsandel eller en tredjedel eller mer av stemmene eller aksjekapitalen i det neste foretaket i rekken.
Heller ikke foretak som tar syke i behandling, kan gis apotekkonsesjon, jf. § 2-3 første ledd bokstav b. Det samme gjelder foretak som direkte eller indirekte eies med ti prosent eller mer av foretak som tar syke i behandling, eller av foretak som har kontroll over slikt foretak, og i de tilfellene søker har kontroll over et foretak som tar syke i behandling. Når det foreligger slik kontroll, er definert i apotekloven § 2-3 annet ledd som er nevnt over. Det er hensynet til et rasjonelt legemiddelforbruk som begrunner forbudet, se de ovennevnte uttalelsene fra Ot.prp. nr. 61 (2000–2001).
Bestemmelsen innebærer at det som hovedregel ikke skal være mulig å ha apotekkonsesjon og samtidig eie sykehus eller andre foretak som tar syke i behandling. Det følger imidlertid av apotekloven § 2-5 at apotekkonsesjon til sykehusapotek kan gis til staten, kommuner, fylkeskommuner og til foretak som eies helt av stat, kommune eller fylkeskommune. Konsesjon til sykehusapotek kan også gis til privat søker forutsatt at vilkårene i § 2-2 og § 2-3 første ledd bokstav a, b og d er oppfylt. I Ot.prp. nr. 61 (2000–2001) kapittel 2.1 heter det:
«Hvis et foretak som tar syke i behandling dekker sine legemiddelutgifter selv, er det på den annen side lite betenkelig om foretaket også eier apotek, ettersom det da ikke vil være noe å hente økonomisk på å øke apotekets salg til sykehuset. Dette er bakgrunnen for at sykehuseiere har anledning til å eie sykehusapotek, både etter gjeldende lov og apotekloven av 1963. Imidlertid er selve sykehuset avskåret fra å eie apotek. Dette har vært ansett som nødvendig av flere årsaker. Sykehuseide apotek ville fort blitt en integrert del av sykehuset, på linje med en sykehusavdeling, med konkurransemessige fordeler som ingen eller lav husleie, gratis administrative tjenester, fri bruk av sykehusets transportapparat m.v. For konkurrentene ville det da vært nærliggende å kreve at apoteket måtte begrense sin virksomhet til å levere legemidler til sykehuset. I så fall ville apoteket hatt samme funksjon som en farmasøytisk sykehusavdeling, ettersom det er ekspedering av resept til tredjeperson, utskrevne og polikliniske pasienter, ansatte og lokalmiljøet, som gjør virksomheten til apotek i lovens forstand.
Videre taler effektivitetshensyn mot at sykehus skal ha anledning til å eie apotek. Eierskap ville gitt sykehusene en binding til å kanalisere sine legemiddelinnkjøp gjennom eget apotek. Uten eierskap til sykehusapoteket står sykehuset friere i valg av leverandør, og det er rom for å innhente alternative anbud. Det er grunn til å tro at dette er et forhold som bidrar til effektiv drift i disse apotekene og lavere legemiddelkostnader for sykehusene.
Et tredje hensyn som begrunner reglene som hindrer sykehusene i å eie apotek, er hensynet til sykehusapotekernes faglige og organisatoriske autonomi. Apotekerens uavhengige stilling i forhold til sykehusets ledelse, samtidig som apoteket står i et nært forhold til sykehusets leger og øvrige brukere, antas å være en viktig årsak til at sykehusapotekene generelt leverer tjenester og produkter av meget høy kvalitet til sykehusene.»
4.4.3 Et apotek er et fysisk sted
Innledning
Apotekloven § 1-3 bokstav a definerer apotek som «et salgssted for legemidler til sluttbruker hvor det gis legemiddelfaglig veiledning, som er fysisk tilgjengelig for publikum». Definisjonen ble endret ved lov 19. juni 2009 nr. 71 om endringer i apotekloven. Tidligere ble apotek definert som et salgs- og tilvirkningssted for legemidler til sluttbruker, som var fysisk tilgjengelig for publikum. I Ot.prp. nr. 91 (2008–2009) side 10 står det:
«Definisjonen av apotek ble foreslått endret slik at det ikke lenger inngår i definisjonen at et apotek er et tilvirkningssted for legemidler. Selv om apotek har leveringsplikt på nødvendige apotekfremstilte legemidler, er det under en tredjedel av apotekene som selv har eller bruker egen tilvirkertillatelse, og antallet er synkende. Flertallet oppfyller kravet til leveringsplikt gjennom avtale med tilvirkere. Etter etableringen av ordningen med salg av legemidler utenom apotek (LUA-ordningen) er heller ikke salgssted for legemidler et begrep som entydig avgrenser hva som er å anse som apotek. En av de viktigste funksjonene til apotek er å gi legemiddelfaglig veiledning. Det ble derfor foreslått å endre definisjonen slik at den gjenspeiler nettopp dette.»
Departementet fremholdt videre:
«Hovedformålet med å definere apotek er å presisere at et apotek er «et sted», og ikke en juridisk enhet. Ved flere anledninger har det blitt stilt spørsmål ved om et apotek, eksempelvis inne i ett og samme kjøpesenter, kan fordeles over flere lokaler med publikumssalg og under ledelse av samme apoteker. Dette har blitt avvist med den begrunnelse at virkeområdet for driftskonsesjonen er et apotek. Det er dermed krav om en apoteker for hvert lokale med publikumssalg. Bakgrunnen for dette er blant annet at apoteker skal være til stede og ha tilstrekkelig oversikt over driften. Et apotek kan imidlertid ha andre deler av sin virksomhet, for eksempel tilvirkning av legemidler, i andre lokaler enn den delen hvor publikumssalget og reseptekspedisjonen foregår.»
Dagens apoteklov åpner dermed ikke for etablering av rene nettapotek. I forvaltningspraksis er det lagt til grunn at også virksomheter som ønsker å etablere nettapotek, må tilby et fysisk tilgjengelig apoteklokale. Det samme vil gjelde for rene multidoseapotek og eventuelt rene nettapotek som kun leverer til profesjonell sluttbruker.
Geografisk begrensning
Apotekloven § 2-7 sier at apotekkonsesjonen omfatter «et bestemt apotek i et bestemt geografisk område». Av apotekforskriften § 3 fremkommer det at «Apotekkonsesjon skal normalt gis med virkning for en bestemt kommune. Dersom apotekets naturlige kundegrunnlag tilsier det, kan apotekkonsesjon gis med virkning for annet geografisk område enn kommune». I Legemiddelverkets utredning av nettapotek fra 29. mars 2021 står det:
«Fordi forsendelsesbegrensningene har vært opphevet siden 2016, er noe av formålet bak lokaliseringsreguleringen endret. Det kan virke ulogisk å binde apotekkonsesjonen til et begrenset geografisk område, spesielt for rene nettapotek. Siden alle apotek nå kan sende legemidler til kunder i hele landet (uavhengig av netthandel), kan ethvert apotek i prinsippet påberope seg hele landet som kundegrunnlag i søknad om apotekkonsesjon.»
Filialapotek
I tillegg til hovedapoteket kan det gis tillatelse til drift av inntil tre filialapotek, jf. apotekloven § 3-4. I følge Legemiddelverkets oversikt var det 56 filialapotek 10. januar 2022.
Filialapotek tillates bare når det kan dokumenteres et behov for apotek på stedet og at det ikke har latt seg gjøre å ansette en apoteker. Et filialapotek driftes av apoteker ved et hovedapotek, mens den stedlige ledelsen ivaretas av en filialbestyrer med autorisasjon som provisorfarmasøyt eller reseptarfarmasøyt. Det er apotekers ansvar å sørge for at filialapoteket er under stedlig ledelse av en person som fyller disse vilkårene. Et filialapotek er underlagt hovedapotekets apotekkonsesjon og driftskonsesjon.
Adgangen til å opprette filialapotek var tidligere viktig som følge av at det ble gitt få apotekkonsesjoner. Det gir lettere tilgang til legemidler for befolkningen på mindre steder uten et selvstendig apotek.
Flere lokasjoner på én apotekkonsesjon
Legemiddelverket har i sin forvaltningspraksis stilt krav om at apotekets kjernevirksomhet, som er farmasøytkontoll, reseptekspedisjon og veiledning, skal foregå i lokalet som er ment å være apotekets hovedlokale. Praksisen er blant annet begrunnet i apotekloven § 2-7, som fremholder at en apotekkonsesjon omfatter et bestemt apotek i et bestemt geografisk område. Videre fremkommer det i apotekloven § 3-2 at apotekeren skal være daglig leder for apoteket, og i følge § 3-6 skal apotekeren sørge for at virksomheten til enhver tid oppfyller faglige krav til apotekvirksomhet som følger av lov, forskrift, vedtak og god apotek- og tilvirkningspraksis. I tilknytning til dette stiller apotekforskriften § 15 krav om at apotekeren skal være til stede i apoteket og i tilhørende filialapotek en tid minst tilsvarende en halv stilling. Dette skal sikre at vedkommende ivaretar sine funksjoner som daglig leder. Videre fremkommer det at apotekeren skal utføre en vesentlig del av sine lederoppgaver i apotekets lokaler, eller i lokaler beregnet på dette i apotekets umiddelbare nærhet. Dette er bakgrunnen for forvaltningspraksis med å sette begrensninger på geografisk avstand mellom ulike lokasjoner for ett apotek.
Utkontraktering av apotekaktiviteter
Gjeldende apoteklov forstås slik at sentrale lovpålagte oppgaver må utøves i eller i geografisk nærhet til apoteket og av apotekets egne ansatte. Apotekets tilvirkning av legemidler kan imidlertid utkontrakteres i medhold av apotekloven § 7-1. Av Legemiddelverkets utredning om nettapotek fremkommer det i punkt 6.1.3.6:
«Reseptekspedisjon er en oppgave som etter dagens regulering ikke kan utføres av andre aktører enn apoteket selv. Farmasøytkontrollen ansees som en del av reseptekspedisjonen, og en del av detaljomsetningen som skal utføres av apotek, og dermed ikke kan utkontrakteres, jf. legemiddelloven § 16 annet ledd. Hovedargumentet har vært at utkontraktering av denne oppgaven er betenkelig med tanke på fragmentering av ansvaret for reseptekspedisjonen. Legemiddelverket anser som nevnt reseptekspedisjon for å være selve kjernevirksomheten i apotekene og en oppgave apotekene har enerett til å utøve, med visse unntak. Dette bør utredes nærmere.
Det er også behov for å utrede om det samme vil gjelde for lagerhold, plukking, pakking og forsendelse fra nettapotek til pasienter/privatpersoner (sluttbrukere). Utkontraktering av disse oppgavene til andre aktører som grossister eller 3PL er ikke lovlig i henhold til dagens regulering i legemiddelloven § 16 annet ledd der det står at detaljomsetning med legemidler skal foregå i apotek. I nyere tid har det vært akseptert at apotek som tilbyr netthandel med reseptfrie legemidler, kan samlokalisere en pakke- og distribusjonsenhet av apoteket hos samarbeidende legemiddelgrossist. Apotekeren har da det daglige ansvaret for disse faglige aktivitetene hos grossisten. For i praksis å kunne føre tilstrekkelig kontroll med ekspedering og utsending har Legemiddelverket stilt krav om geografisk nærhet mellom apoteket og grossisten. Et apotek kan derfor søke om å inkludere den delen av lagerlokalet hvor legemidlene oppbevares i apotekets allerede godkjente lokaler. En slik vesentlig endring i apoteklokalet skal godkjennes av Legemiddelverket, jf. apotekforskriften § 19. I tilfeller der dette har blitt akseptert, så har lokalene vært godkjent som en del av apoteklokalet og personalet har vært å anse som innleid av apoteket. Videre må den delen av lageret som det søkes om å inkludere i apotekets lokaler tydelig avgrenses fra resten av lageret, og det må være adgangskontroll til denne delen.»
4.4.4 Apotekenes oppgaver
Apotekene har flere lovpålagte oppgaver og plikter:
Forhandlingsplikt, leveringsplikt og lagerplikt.
Reseptekspedisjon og farmasøytkontroll.
Informasjons- og veiledningsplikt.
Tilby praksisplasser.
Utmelding fra legemiddelverifiseringssystemet.
Nødekspedisjon.
Prisopplysningsplikt.
Meldeplikt om kvalitetssvikt.
Offentlig informasjon om legemidler.
Retur av legemidler til destruksjon.
Narkotikaregnskap.
Internkontroll.
Lovpålagte oppgaver og plikter er nærmere omtalt i kapittel 7 sammen med øvrige oppgaver og tjenester.
Markedsføring og reklame
Apotekeren skal påse at medisinsk informasjon som apoteket gjør tilgjengelig for publikum, er utarbeidet i overensstemmelse med gjeldende regler om reklame for legemidler, jf. apotekforskriften § 46. Forskriften om reklame for legemidler til mennesker fremkommer av legemiddelforskriften kapittel 13. Reglene gjennomfører EUs harmoniserte regler om reklame for legemidler til mennesker som fremgår av direktiv 2001/83/EF artikkel 86-100.
For legemidler til dyr fremkommer reklamereglene av forordning (EU) 2019/6 om legemidler til dyr artikkel 119 til 121. Forordningen gjelder som norsk lov, jf. legemiddelloven § 2 b. Reklamereglene i forordningen samsvarer i det vesentligste med reglene som gjelder for legemidler til mennesker, men detaljeringsgraden er mindre, jf. Prop. 102 LS (2021–2022) side 45 og 46.
I det følgende omtales reglene om reklame for legemidler til mennesker. Reklame for legemidler defineres som «enhver form for oppsøkende informasjonsvirksomhet, kampanjer, holdningspåvirkning og andre tiltak som har til hensikt å fremme forskrivning, utlevering, salg eller bruk av legemidler til mennesker og dyr», jf. legemiddelforskriften § 13-1. Reklamebestemmelsene omfatter imidlertid ikke «korrespondanse, eventuelt sammen med informasjonsmateriell som ikke har karakter av reklame, som kreves for å besvare et spesifikt spørsmål om et bestemt legemiddel» og heller ikke «tekniske bruksanvisninger forutsatt at den bare gjengir pakningsvedlegget», jf. legemiddelforskriften § 13-2.
Reklame for reseptpliktige legemidler kan bare rettes mot lege, tannlege, veterinær, fiskehelsebiolog, offentlig godkjent sykepleier, farmasøyt, optiker, tannpleier, samt studenter i disse fag, jf. legemiddelforskriften § 13-4 og § 13-1. Reklamen skal samsvare med opplysningene i preparatomtalen som er godkjent av Legemiddelverket, fremme rasjonell bruk av legemidlet ved å presentere det objektivt uten å overdrive dets egenskaper og ikke være misvisende eller villedende, jf. legemiddelforskriften § 13-3 og EU-domstolens avgjørelse i sak C-249/09 om informasjon som lovlig kan supplere innholdet i den godkjente preparatomtalen. Kravene innebærer at innholdet i reklamen begrenses av innholdet i vedtaket om markedsføringstillatelse for legemidlet.
I henhold til Legemiddelverkets praksis regnes bilder av reseptpliktige legemiddelpakninger som reklame. Nettapotek kan derfor som hovedregel ikke vise slike bilder til allmennheten. Av Legemiddelverkets hjemmeside fremkommer:
«Nettapotek er likestilt med fysiske apotek når det gjelder å vise frem reseptpliktige legemidler til kundene når de er innlogget og i ekspedisjonsfasen. Dette defineres som en rådgivningsfase, og det er dermed lov å vise et bilde av legemiddelpakningen mot en nøytral bakgrunn uten at det regnes som reklame. Bildet må ikke vise en situasjon der legemidlet brukes.
I ekspedisjonsfasen er det også tillatt å gi informasjon om et spesifikt legemiddel og oppgi pris når kundene spør om det.
Med dette kan kundene kjenne igjen legemidler som er brukt tidligere. Hvis det er et generisk legemiddel så blir de gjort kjent med at det ser annerledes ut, men at det inneholder det samme som legen har skrevet i resepten. Dette er viktig informasjon som bidrar til riktig bruk av legemidler.»
Apoteket kan ikke fremstille priser og rabatter i sin markedsføring på en måte som kan fremme tilfeldige kjøp av legemidler, jf. apotekforskriften § 49.
Lov 9. januar 2009 nr. 2 om kontroll med markedsføring og avtalevilkår mv. (markedsføringsloven) gjelder i forbrukerforhold og stiller i tillegg krav til god forretningsskikk mellom næringsdrivende. Loven gjennomfører i det aller vesentligste direktiver og forordninger som omfattes av EØS-avtalen. Loven gjelder også for markedsføring i apotek. Markedsføringsloven stiller krav om at påstander i markedsføring om faktiske forhold, herunder om ytelsers egenskaper eller virkning, skal kunne dokumenteres, jf. markedsføringsloven § 3. Dokumentasjonen skal foreligge på annonsørens hånd når markedsføringen skjer. Overholdelse av denne bestemmelsen kan imidlertid ikke i seg selv antas å forhindre brudd på de særskilte reglene om reklame for legemidler som stiller tilleggskrav om at reklamen skal samsvare med opplysningene i legemidlets godkjente preparatomtale.
4.4.5 Medisinutsalg og pakkekommisjonærer
I områder uten apotekdekning kan apotek gis tillatelse til å etablere medisinutsalg for å sikre befolkningen tilgang til apotektjenester, jf. apotekloven § 2-7 annet ledd bokstav a og § 2-8 første ledd bokstav e. Normalt etableres medisinutsalg i tilknytning til en matvarebutikk.
Tillatelse til medisinutsalg gis innen et bestemt område, i praksis oppgitt som poststed, og ikke til en bestemt butikk. Flere medisinutsalg på samme sted tillates. Avstanden til nærmeste apotek skal normalt være minst ti kilometer, men det kan tas hensyn til lokale forhold som for eksempel dårlige fergeforbindelser.
I henhold til apotekforskriften § 58 skal apotekeren i samråd med kommunelegen utarbeide og ajourføre liste over varer som medisinutsalget skal føre. Listen skal omfatte de legemidlene som er nødvendige for å ivareta befolkningens behov for legemidler til egenomsorg. LUA-utsalg kan delvis erstatte medisinutsalg, men medisinutsalg kan også utlevere reseptfrie legemidler som ikke er omfattet av LUA-ordningen.
Som for LUA-utsalg er det ikke tillatt å utlevere legemidler til personer under 18 år fra medisinutsalg, jf. apotekforskriften § 56. Legemidlene i medisinutsalget er i henhold til apotekforskriften § 60 apotekets eiendom, og utlevering av legemidler skal skje etter skriftlige retningslinjer gitt av apoteket, jf. apotekforskriften § 56. Dette innebærer at medisinutsalg kan gi veiledning i forbindelse med utlevering av legemidler, noe som ikke er tillatt i LUA-utsalg.
Ofte fungerer medisinutsalgene også som pakkekommisjonærer for apotekene. Det vil si at utsalgene utleverer ferdige pakker med reseptpliktige legemidler til kunder på vegne av apoteket. I områder av landet der det er langt til nærmeste apotek, er utlevering fra pakkekommisjonærer viktig for å sikre befolkningen tilgang til reseptpliktige legemidler. Det inkluderer utlevering av legemidler som krever kjølig oppbevaring. Per i dag er det få eller ingen nettapotek som sender kjølevarer over lengre avstander, og pakkekommisjonærene spiller derfor fremdeles en viktig rolle for tilgangen til legemidler i visse områder.
4.4.6 Tilsyn
Det følger av apotekloven § 8-1 at Helse- og omsorgsdepartementet er tilsynsmyndighet og fører tilsyn med at krav til apotekvirksomhet i lov og forskrifter er oppfylt. Myndigheten er delegert til Legemiddelverket. Legemiddelverket fører også tilsyn i medhold av legemiddelloven, jf. legemiddelloven § 28. Dette vil blant annet gjelde tilsyn med at apotek overholder reglene om reklame for legemidler. Helsetilsynet fører tilsyn med at ansatte i apotek overholder kravene i helsepersonelloven.
Brudd på bestemmelser i apotekloven og i forskrifter kan sanksjoneres. Apotekkonsesjon og driftskonsesjon kan tilbakekalles i medhold av apotekloven § 2-13 og § 3-9. Den som er gjenstand for tilsyn, plikter å medvirke ved blant annet å sørge for at tilsynsmyndigheten har uhindret tilgang til apotek, og at tilsynsmyndigheten har tilgang til nødvendig dokumentasjon og legemidler og andre varer til nærmere undersøkelse og kontroll, jf. apotekloven § 8-2. Manglende medvirkning kan resultere i tilbakekall av tillatelse. Ved avvik fra gjeldende krav kan tilsynsmyndigheten gi pålegg om retting, jf. apotekloven § 8-3. Det kan videre gis advarsel i medhold av apotekloven § 8-4. Tilsynsmyndigheten kan i medhold av apotekloven § 8-5 stenge apotek. Slik kompetanse foreligger dersom apoteket mangler apotek- og/eller driftskonsesjon. Videre kan apoteket stenges hvis virksomheten kan medføre vesentlig fare for helse og sikkerhet.
Som oppfyllelsespress kan tilsynsmyndigheten fastsette en løpende tvangsmulkt, jf. apotekloven § 9-3. Kompetansen gjelder ved brudd på vilkår som er satt i apotekkonsesjonen, brudd på regnskapsplikten og som oppfyllelsespress for pålegg om retting. Det kan fattes vedtak om overtredelsesgebyr ved brudd på meldeplikten om at annen farmasøyt har overtatt driften av apoteket, jf. apotekloven § 3-8 og § 9-6.
Apotek er også underlagt tilsyn fra Datatilsynet for overholdelse av kravene for håndtering av person- og helseopplysninger.
4.5 Regulering av pris og refusjon for apotekenes varer
4.5.1 Prisregulering
Maksimalpris
Av legemiddelloven § 6 fremkommer det at Kongen gir forskrifter om prisfastsettelse av legemidler. Kompetansen er delegert til Helse- og omsorgsdepartementet, jf. forskrift 8. juni 1995 nr. 521 om delegering av myndighet til Helsedepartementet etter lov om legemidler m.v. I medhold av bestemmelsen er det gitt forskrifter om prisfastsettelse av legemidler, se legemiddelforskriften kapittel 12 og 14. Myndighetene fastsetter maksimalpris for reseptpliktige legemidler til mennesker. Det fastsettes ikke maksimalpriser for reseptfrie legemidler eller for legemidler til dyr. Legemiddelverket fastsetter legemidlers maksimale innkjøpspris til apotek (maksimal AIP), og fra apotek (AUP), jf. legemiddelforskriften § 12-1 og § 12-2.
Ved fastsetting av prisen tas hensyn til prisen på legemidlet i andre EØS-land. I praksis fastsettes maksimalprisene som utgangspunkt basert på en prissammenligning med prisen på legemidlet i Sverige, Danmark, Finland, Storbritannia, Irland, Tyskland, Østerrike, Belgia og Nederland. Maksimal AUP for et reseptpliktig legemiddel med markedsføringstillatelse fremkommer ved at maksimal AIP tillegges maksimal (apotek)avanse. Det er Legemiddelverket som fastsetter avansen, jf. legemiddelforskriften § 12-3 og kapittel 4.5.2.
Legemiddelverket kan gi prisfastsettelsesreglene tilsvarende anvendelse for reseptfrie legemidler når disse refunderes av folketrygden i medhold av blåreseptordningen. Det fastsettes heller ikke maksimalpriser for legemidler som selges på godkjenningsfritak, eller for apotektilvirkede legemidler. For apotektilvirkede legemidler som refunderes av folketrygden, fastsetter Legemiddelverket imidlertid refusjonsprisen. Unntak fra prisfastsettelse etter ovennevnte regler gjøres i praksis dersom det er stor risiko for at legemidlet ikke lenger blir tilgjengelig i markedet hvis beregnet maksimalpris vedtas. I slike tilfeller kan det fastsettes en høyere maksimalpris hvor det tas hensyn til dokumenterte produksjonskostnader.
Trinnpris for byttbare legemidler
Det følger av apotekloven § 6-6 at legemidler skal utleveres nøyaktig etter resept og rekvisisjon. Med apotekloven § 6-6 annet ledd ble det innført adgang til generisk bytte i apotek. Ordningen innebærer at pasienter kan få utlevert et annet generisk likeverdig legemiddel enn det legen har angitt på resepten forutsatt at de er bioekvivalent og medisinske likeverdige, og står oppført på Legemiddelverkets bytteliste.
I forbindelse med Stortingets behandling av statsbudsjettet for 2002 uttrykte Stortinget utilfredshet med manglende insentiver for å redusere priser til brukere på markedet for generiske legemidler. Departementet fulgte opp Stortingets merknad og innførte et indeksprissystem, jf. Ot.prp. nr. 16 (2002–2003).
Indeksprissystemet ble fra 1. januar 2005 erstattet av trinnprissystemet som i en videreutviklet form fortsatt gir reglene for hvordan man fastsetter refusjonspriser på generiske legemidler, jf. legemiddelforskriften § 12-13 følgende. Trinnprismodellen ble innført med formål om å redusere prisene på generiske legemidler og derigjennom redusere folketrygdens og pasientens utgifter knyttet til bruk av slike legemidler. Ordningen ble lovfestet fra 1. januar 2009 etter lovforslag fremsatt i Ot.prp. nr. 58 (2007–2008) Om lov om endringar i legemiddelloven, apotekloven og lov om medisinsk utstyr.
Legemiddelverket oppførte i 2010 biotilsvarende filgrastim på apotekenes bytteliste sammen med det originale biologiske legemidlet. Både Oslo byfogdembete og Oslo tingrett kom til at oppføringen manglet hjemmel i lov, se avgjørelsene i TOBYF-2010-102446 og TOSLO-2010-128688. Fra 1. juli 2021 omfatter apotekloven § 6-6 om bytte imidlertid også biologiske og biotilsvarende legemidler, jf. Prop. 84 L (2020–2021).
Når originallegemidler får konkurranse fra generiske legemidler, reduseres som regel grossistenes innkjøpspris (GIP) gjennom forhandlinger mellom leverandør og grossist. Trinnprisregelverket bidrar til at prisnedgangen når frem til kunden ved at apotek er forpliktet til å skulle kunne utlevere minst ett legemiddel til en utsalgspris lik trinnpris innen hver byttegruppe, jf. legemiddelforskriften § 12-17. Med trinnprismodellen får både folketrygden og pasient utbytte av de lavere prisene.
Legemiddelverket fastsetter hvilke byttegrupper som det skal beregnes trinnpris for, og hvilke legemidler som skal inngå i disse, jf. legemiddelforskriften § 12-14 første ledd. En felles trinnpris for byttegruppen fastsettes når legemidlene er oppført på Legemiddelverkets bytteliste, og originalpreparatet har stabil generisk eller biotilsvarende konkurranse i Norge fra minst ett legemiddel. Stabil generisk eller biotilsvarende konkurranse anses å foreligge når det ikke kan dokumenteres alvorlige leveringsproblemer for det generiske eller biotilsvarende legemidlet, jf. legemiddelforskriften § 12-14 annet og tredje ledd.
Legemiddelforskriften gir regler om hvordan trinnprisen skal beregnes. Utgangspunktet for beregningen av trinnpris er originallegemidlets maksimale AIP da det ble fastsatt maksimalpris for det første konkurrerende generisk likeverdige eller biotilsvarende likeverdige legemidlet (utgangsprisen), jf. legemiddelforskriften § 12-15 første ledd. Frem til 1. januar 2022 var det i regelverket et første, annet og eventuelt tredje kutt etter henholdsvis null, seks og atten måneder. Fra 1. januar 2022 ble første kutt fjernet for syntetiske legemidler. Kuttsatsene varierer fra 25 til 96 prosent. Trinnpris fremkommer ved at utgangspris med prosentreduksjon tillegges maksimal apotekavanse og merverdiavgift, jf. legemiddelforskriften § 12-3. Maksimal apotekavanse beregnes på samme måte som for legemidler uten trinnpris.
Dersom beregning av trinnpris etter bestemmelsene nevnt over gir en urimelig lav pris, kan Legemiddelverket fastsette trinnprisen skjønnsmessig, jf. legemiddelforskriften § 12-15 siste ledd. En del virkestoff har fått fastsatt trinnpris basert på en lavere kuttsats etter denne bestemmelsen. I hovedsak gjelder dette legemidler med lav byttbar omsetning og hvor det er lite rom for lønnsomhet ved generisk konkurranse. Det gjelder også en del legemidler hvor pakningen inkluderer administrasjonsutstyr. I underkant av 20 prosent av virkestoffene på trinnpris har minst ett varenummer med skjønnsmessig fastsatt kutt. Kuttsatser varierer mellom 10 og 49 prosent.
Som utgangspunkt refunderer folketrygden legemidlets trinnpris. Bestemmelser om refusjon av trinnprislegemidler og pasientens egenandel bestemmes av legemiddelforskriften § 12-16 og forskrift 28. juni 2007 nr. 814 om stønad til dekning av utgifter til viktige legemidler mv. (blåreseptforskriften) § 8. Apotek skal kunne utlevere minst ett legemiddel til trinnpris til kundene, jf. legemiddelforskriften § 12-17. Grossister skal tilby apotek legemidler til en AIP, som med et tillegg av maksimal apotekavanse, ikke er høyere enn at apotek kan selge legemidlet til trinnpris-AUP, jf. legemiddelforskriften § 12-18 første ledd.
Pris for øvrige varer
Det fastsettes ikke maksimalpriser for medisinsk forbruksmateriell og næringsmidler. Pasientens kostnader til en del slike produkter dekkes imidlertid av folketrygden. Helfo godkjenner produktene for refusjon, og fastsetter i den forbindelse en refusjonspris, jf. kapittel 4.5.4.
Det fastsettes ikke priser for andre handelsvarer enn de som refunderes av folketrygden. Regelverket åpner imidlertid for at det kan nedlegges forbud mot urimelige priser. Lov 11. juni 1993 nr. 66 om pristiltak har som mål å fremme en samfunnsmessig forsvarlig prisutvikling, hvor det settes forbud mot urimelige priser og forretningsvilkår. Konkurransetilsynet er kontrollmyndighet for loven. I pristiltaksloven § 1 gis det fullmakt til å fastsette priser og andre forretningsvilkår, begrenset til situasjoner hvor det er «nødvendig for å fremme en samfunnsmessig forsvarlig prisutvikling».
Konkurransetilsynet har i liten grad benyttet pristiltaksloven, og utvalget er ikke kjent med at pristiltaksloven er håndhevet overfor apotek. I forbindelse med prisøkning på munnbind under covid-19-pandemien vurderte Konkurransetilsynet imidlertid fortløpende å innføre makspris for munnbind. Konkurransetilsynet undersøkte prisutviklingen på munnbind i Norge i perioden, men selv om prisen økte, tydet ikke undersøkelsen på at prisøkningen i de norske apotekene var urimelig. Konkurransetilsynet valgte å ikke innføre en makspris for munnbind. Det ble lagt vekt på at en makspris kunne føre til mangel på munnbind (Konkurransetilsynet, 2020).
Prisregulering i andre ledd i forsyningskjeden
Legemiddelprodusentenes pris til grossist, det vil si grossistenes innkjøpspris (GIP), og grossistens avanse er i utgangspunktet ikke lovregulert. Dette innebærer at produsentenes pris til grossist og dermed også grossistens avanse som utgangspunkt bestemmes av avtaler mellom legemiddelprodusent og grossist. Maksimal AIP er imidlertid den høyeste prisen grossister kan selge legemidler for til apotek.
I medhold av legemiddelloven § 6 fjerde ledd kan imidlertid departementet i forskrift pålegge grossister en maksimal avanse ved distribusjon av legemidler som apotek har fremforhandlet direkte med leverandør. Bestemmelsen er fastsatt med bakgrunn i trinnprissystemet. I departementets høring av bestemmelsen i 2006 heter det:
«Departementet ønsker å sikre apoteks mulighet til å inngå direkte avtaler med leverandør. Det er viktig at de rabattene som oppnås i direkte i forhandlinger med leverandør videreføres gjennom grossistleddet. Departementet vurderer derfor å fastsette et generelt tak på grossistavansen for apoteks leveranser fremforhandlet direkte med produsent, slik at apotek kan nyte godt av oppnådd forhandlingsresultat i form av økt apotekavanse. Ordlyden i legemiddelforskriften § 12-19 er foreslått endret slik at grossistavansen, i tilfeller der apotek selv inngår avtaler med leverandørene, reguleres til maksimalt 15 prosent av GIP. Endringen innebærer at dagens ordning, som bare gjelder to av landets grossister og selvstendige apotek, kan utvides til å gjelde alle grossister og alle apotek.»
I dag lyder legemiddelforskriften § 12-18 annet ledd slik:
«Grossister kan ikke kreve en avanse som overstiger 15 prosent av grossistens innkjøpspris, for legemidler som omfattes av § 12-14 og apoteket selv har inngått leverandøravtale for. Dersom en avanse på 15 prosent er åpenbart urimelig, kan det i enkelttilfeller gjøres unntak.»
Helse- og omsorgsdepartementet sendte i 2020 på høring et forslag om at det gis hjemmel i legemiddelloven § 6 tredje ledd til å fastsette grossistavansen for helseforetaksfinansierte legemidler i grossistforskriften. I høringen viste departementet til at produsentenes pris til grossist og dermed også grossistens avanse som utgangspunkt bestemmes av avtaler mellom legemiddelprodusent og grossister. I høringen fremholdt departementet:
«Sykehusinnkjøp HF v/ divisjon legemidler (heretter LIS) anskaffer i betydelig grad disse legemidlene gjennom anbud hvor produsentene inngir tilbud om LIS grossist innkjøpspris (LIS GIP). LIS anskaffer også grossisttjenesten for h-reseptlegemidlene (heretter grossistavtale). I dag foreligger det grossistavtale mellom de regionale helseforetakene og grossistene Alliance HealthCare Norge AS (AHN) og Norsk Medisinaldepot AS (NMD) om distribusjon av legemidler til bruk i sykehus og tilsvarende distribusjonsavtale for h-reseptlegemidler og LAR-legemidler til bruk i og utenfor sykehus. Avtalene som blir inngått med legemiddelprodusenter og grossister gjennom anbud gjennomført av LIS, sikrer helseforetakene en innkjøpspris som er lavere enn det som følger av myndighetsfastsatte maksimale AIP. I medhold av legemiddelloven § 6 fjerde ledd kan departementet i forskrift pålegge grossister en maksimal avanse ved distribusjon av legemidler som apotek har fremforhandlet direkte med leverandør. Bestemmelsen er fastsatt med bakgrunn i trinnprissystemet.»
Departementet viste etter dette til ovennevnte uttalelser i den gjengitte høringen fra 2006. Departementet fremholdt at det er viktig at de rabattene som LIS oppnår i anskaffelser og direkte i forhandlinger med legemiddelprodusent, videreføres gjennom grossistleddet, og at dette så langt har vært sikret ved at grossister gjennom grossistavtale har forpliktet seg til å distribuere legemidlene til fremforhandlet pris med tillegg av avtalt grossistavanse. Departementet uttalte videre:
«Skulle det imidlertid oppstå en situasjon hvor slik grossistavtale ikke foreligger, er det den fastsatte maksimal AIP som bestemmer sykehusenes maksimale innkjøpspris – noe som kan innebære at helseforetakenes fremforhandlede rabatter ikke nødvendigvis når frem til helseforetakene. Departementet foreslår derfor at det gis hjemmel i legemiddelloven § 6 tredje ledd til å fastsette grossistavansen for helseforetaksfinansierte legemidler i forskrift. I tillegg foreslås det hjemmel for fastsettelse av forskrifter om gjennomføringen av slik distribusjon, herunder krav til sortimentsomfang for helseforetaksfinansierte legemidler, jf. legemiddelloven § 14 tredje ledd.»
Det er i ettertid inngått avtaler mellom helseforetakene og alle de tre kjedene om distribusjon av h-reseptlegemidlene. Høringsforslaget er hittil ikke fulgt opp.
4.5.2 Avanseregulering
Det følger av legemiddelforskriften § 12-3 at maksimal (apotek)avanse fastsettes av Legemiddelverket. Det fremkommer ikke i lov eller forskrift på hvilket grunnlag apotekavansen skal beregnes. Det redegjøres nærmere for avansereguleringen i kapittel 7.5.4.
I Ot.prp. nr. 29 (1998–99) fremgår det at apotekenes avansesatser fastsettes av Sosial- og helsedepartementet etter råd fra Helsetilsynet. I Innst.O. nr. 52 (1999–2000) Innstilling fra sosialkomiteen om lov om apotek heter det:
«Komiteen mener det er nødvendig at departementet vurderer retningslinjer og mekanismer for fastsetting av apotekavansen.
Stortinget selv har gjort vedtak om regulering av apotekavansen uten nærmere utredning om grunnlaget for slik regulering, og departementet har også foreslått endringer uten at dette har vært knyttet til kontrollerbare kriterier for fastsetting av avansenivå.
Komiteen mener at det både for Stortinget som vedtaksmyndighet og for apoteknæringen selv er viktig med mest mulig klare retningslinjer på dette området, og ber departementet utarbeide helhetlige og mest mulig entydige regler som grunnlag for fastsetting av apotekavansen.
Komiteen fremmer følgende forslag:
Stortinget ber Regjeringen på egnet måte forelegge Stortinget et opplegg der kriterier for fastsetting av apotekenes avanse utredes og klargjøres.»
I henhold til St.meld. nr. 18 (2004–2005) skal apotekavansen evalueres hvert fjerde år. Blant annet skal apotekenes totale rammevilkår vurderes. Apotekavansen ble senest evaluert av Legemiddelverket i 2020 på oppdrag fra Helse- og omsorgsdepartementet. I oppdraget viste departementet blant annet til at evalueringen skal omfatte en beskrivelse av apotekenes overordnete rammevilkår, herunder utviklingen av lønnsomhet i apotekdrift samt utviklingen av apotekenes konkurransesituasjon.
I Legemiddelverkets evaluering av apotekavansen i 2020 heter det:
«Apotekavansen skal dekke kostnader apoteket har i forbindelse med lovpålagte oppgaver og plikter knyttet til resept- og varehåndteringen. Disse oppgavene er utdypet i lover, forskrifter og rundskriv. Apotekavansen må ses på som en del av de samlede rammevilkår som skal skape grunnlag for avkastning til eierne av apotekene i Norge. Når myndighetene vurderer å innføre nye plikter, skal kostnader ved det utredes. Samtidig er det ikke gitt at kostnadene skal kompenseres direkte i apotekavansen. Det er rimelig å forvente at apotekene effektiviserer sin virksomhet gjennom endringer i prosesser og bruk av teknologi. Det er apotekene selv som har den beste informasjonen om sitt eget kostnadsbilde.» (Statens legemiddelverk, 2020)
4.5.3 Refusjonsordninger
Folketrygdfinansierte legemidler (folketrygdloven med forskrifter)
Etter lov 28. februar 1997 nr. 19 om folketrygd (folketrygdloven) kapittel 5 gis hel eller delvis kompensasjon for nødvendige utgifter til helsetjenester ved sykdom, skade mv., jf. formålsbestemmelsen i folketrygdloven § 5-1. Stønad til viktige legemidler, spesielt medisinsk utstyr og forbruksmateriell, ytes etter folketrygdloven § 5-14. Det er et vilkår at det er behov for langvarig bruk av legemidlet, det medisinske utstyret eller forbruksmateriellet, og at det ovennevnte er rekvirert av lege til bruk utenom sykehus. Helse- og omsorgsdepartementet kan gi forskrifter om stønad etter folketrygdloven § 5-14. Slike bestemmelser er gitt i blåreseptforskriften og i legemiddelforskriften kapittel 14.
Etter folketrygdloven § 5-22 kan folketrygden yte bidrag til dekning av utgifter til helsetjenester når utgiftene ikke ellers dekkes etter loven eller andre lover (bidragsordningen). Refusjon gis i henhold til retningslinjer gitt av Helsedirektoratet og omfatter blant annet prevensjonsmidler og legemidler til bruk ved infertilitetsbehandling (Helsedirektoratet, 1997).
Etter blåreseptforskriften kan det gis stønad til legemidler etter tre ulike ordninger: Forhåndsgodkjent refusjon i medhold av blåreseptforskriften § 2, individuell stønad i medhold av blåreseptforskriften § 3 og stønad til legemidler ved smittsomme sykdommer i medhold av blåreseptforskriften § 4. Sistnevnte ordning er også hjemlet i lov 5. august 1994 nr. 55 om vern mot smittsomme sykdommer (smittevernloven) § 6-2.
Ved forhåndsgodkjent refusjon § 2 ytes det stønad for legemidler som er oppført på refusjonslisten. Oppføring på refusjonslisten skjer etter bestemmelsene i legemiddelforskriften kapittel 14, se særlig legemiddelforskriften § 14-8. Slike legemidler kan rekvireres direkte av pasientens lege uten særskilt søknad, forutsatt at legemidlet er rekvirert i samsvar med vilkår og begrensninger som fremgår av refusjonslisten.
Blåreseptforskriften § 3 gir hjemmel for at det ytes stønad til legemidler som ikke har forhåndsgodkjent refusjon. Det må foreligge tungtveiende medisinske hensyn for å yte stønad i tilfeller der det finnes relevante forhåndsgodkjente legemidler for den aktuelle sykdommen. Stønad etter denne bestemmelsen ytes etter individuell søknad. I blåreseptforskriften § 3 sjette ledd fremgår det at søknad om individuell stønad på blå resept for legemidler skal fremsettes av lege på vegne av pasient.
Ordningen med individuell stønad benyttes også i tilfeller hvor legemidlet oppfyller kriteriene for forhåndsgodkjent refusjon, men der det samtidig er betydelig risiko for rekvirering utenfor refusjonsvilkårene, eller der det av andre grunner er behov for særlig kontroll av rekvirering og bruk av legemidlet, jf. legemiddelforskriften § 14-8 annet ledd. Helsedirektoratet har delegert adgangen til å treffe vedtak om stønad etter blåreseptforskriften § 3 til Helfo.
Vedtak om forhåndsgodkjent refusjon og individuell stønad forutsetter at Legemiddelverket har gjennomført en metodevurdering, jf. legemiddelforskriften § 14-3 og blåreseptforskriften § 3. Metodevurderingen gjøres på grunnlag av dokumentasjon som legemiddelfirmaet sender inn til Legemiddelverket, jf. legemiddelforskriften § 14-4. Metodevurderingen innebærer en samlet vurdering av prioriteringskriteriene nytte, ressursbruk og alvorlighet.
Forhåndsgodkjent refusjon kan bare innvilges dersom ressursbruken står i rimelig forhold til nytten av legemidlet, hensyntatt tilstandens alvorlighet, jf. legemiddelforskriften § 14-5. Det følger av legemiddelforskriften § 14-7 at forhåndsgodkjent refusjon for et legemiddel ikke kan innvilges uten Stortingets samtykke, dersom budsjettvirkningen overstiger 100 millioner kroner i minst ett av de første fem årene etter refusjonsvedtaket ble fattet. Ved betydelig risiko for rekvirering utenfor refusjonsvilkårene eller der det av andre grunner er behov for særlig kontroll av rekvirering og bruk av legemidlet, skal det fattes avslag på forhåndsgodkjent refusjon. I slike tilfeller kan det som nevnt over ytes stønad etter søknad for den enkelte pasient etter reglene om individuell stønad i blåreseptforskriften § 3.
Refusjonspris
Samtidig som Legemiddelverket fatter vedtak om forhåndsgodkjent refusjon, skal det fastsettes en refusjonspris for legemidlet, jf. legemiddelforskriften § 14-9. Legemidlets maksimalpris vil normalt være utgangspunktet for Legemiddelverkets vurdering av om legemidlet oppfyller kriteriene for å innvilges forhåndsgodkjent refusjon etter bestemmelsene i legemiddelforskriften kapittel 14. I en del tilfeller vil denne prisen være for høy til at kriteriene for innvilgelse av forhåndsgodkjent refusjon, herunder kostnadseffektivitet, er oppfylt, jf. legemiddelforskriften § 14-5. I slike tilfeller kan det fastsettes en lavere refusjonspris etter avtale med legemidlets rettighetshaver, jf. legemiddelforskriften § 12-8. Formålet skal være at legemidlet skal kunne innvilges forhåndsgodkjent refusjon. Dersom det fastsettes en refusjonspris som er lavere enn maksimalpris fastsatt etter de alminnelige reglene i legemiddelforskriften kapittel 12, gjelder denne som ny maksimalpris for legemidlet.
Refusjonskontrakter og anbud
Etter legemiddelloven § 6 sjette ledd kan det offentlige og legemidlets rettighetshaver inngå en refusjonskontrakt om offentlig finansiering av et legemiddel.
Inngåelse av refusjonskontrakt mellom det offentlige og legemiddelfirmaet skal, på samme måte som ved refusjonsvedtak, sikre at folketrygden yter stønad til dekning av nødvendige utgifter til viktige legemidler. Det er ikke gitt nærmere forskriftsbestemmelser vedrørende refusjonskontrakter.
Refusjonskontrakter inngås særlig i to situasjoner. Den ene er når legemidlet ikke er kostnadseffektivt til maksimalpris og derfor ikke oppfyller vilkårene for å innvilges forhåndsgodkjent refusjon etter bestemmelsene i legemiddelforskriften kapittel 14. Den andre er der vedtak om forhåndsgodkjent refusjon vil lede til en vekst i utgifter til legemidler for folketrygden som overstiger 100 millioner kroner i minst ett av de første fem årene etter tidspunktet for refusjonsvedtaket. I sistnevnte tilfelle må Stortingets samtykke innhentes. Refusjonskontrakter benyttes i disse tilfellene til å oppnå rabatter som medfører at legemidlene kan godkjennes for forhåndsgodkjent refusjon og for at utgiftene skal komme under fullmaktsgrensen på 100 millioner kroner.
Helsedirektoratet har per i dag seks refusjonskontrakter for to grupper av legemidler: PCSK9-hemmere mot høyt kolesterol, og CGRP-hemmere til forebyggende behandling av kronisk migrene.
I Prop. 1 S (2021–2022) ble det foreslått å gjennomføre en pilot for anbud på kolesterolsenkende legemidler (PCSK9-hemmere) i 2022. Det er i forberedelsen av anbudspiloten fastsatt forskrift 13. juni 2022 nr. 1026 om endring i forskrift om legemidler og i blåreseptforskriften. I forskriftene er det blant annet inntatt bestemmelser som klargjør at resultatene fra anskaffelsen, sammen med Legemiddelverkets metodevurdering, inngår som en del av beslutningsgrunnlaget for vedtak om refusjon etter legemiddelforskriften kapittel 14. Anbudet ble gjennomført i 2022. Resultatene av anbudskonkurransen omtales i kapittel 12.3.3.
Helseforetaksfinansierte legemidler (spesialisthelsetjenesteloven)
Det følger av lov 2. juli 1999 nr. 61 om spesialisthelsetjenesten m.m. (spesialisthelsetjenesteloven) at staten har det overordnede ansvar for at befolkningen gis nødvendig spesialisthelsetjeneste, jf. spesialisthelsetjenesteloven § 2-1. De regionale helseforetakene har ansvar for å sørge for at befolkningen i de respektive regionene tilbys spesialisthelsetjenester, jf. spesialisthelsetjenesteloven § 2-1 a.
Der spesialisthelsetjenesten har behandlingsansvar for en legemiddelbehandling, plasseres finansieringsansvaret hos de regionale helseforetakene, jf. blåreseptforskriften § 1b annet ledd. Dette gjelder også legemiddelbehandling som skjer utenfor sykehus, som i dag omfatter rekvirering på h-resept i tillegg til LAR-legemidler og legemidler til tarmtømming. H-reseptordningen ble opprettet for legemidler som pasienten kan administrere selv, men hvor utgiftene likevel skal dekkes av de regionale helseforetakene. H-reseptlegemidler kan hentes ut ved alle landets apotek, jf. forskrift 12. juni 2015 nr. 646 om helseforetaksfinansierte reseptlegemidler til bruk utenfor sykehus § 6.
Helseforetakene anskaffer i betydelig grad disse legemidlene gjennom anbud gjennomført av Sykehusinnkjøp HF, og hvor produsentene inngir tilbud om LIS grossist innkjøpspris (LIS-GIP). Sykehusinnkjøp HF anskaffer også grossisttjenesten for h-reseptlegemidlene (heretter grossistavtale). I dag foreligger det grossistavtale mellom de regionale helseforetakene og grossistene om distribusjon av legemidler til bruk i sykehus og tilsvarende distribusjonsavtale for h-reseptlegemidler og LAR-legemidler til bruk i og utenfor sykehus.
Avtalene som blir inngått med legemiddelprodusenter og grossister gjennom anbud gjennomført av Sykehusinnkjøp HF, sikrer helseforetakene en innkjøpspris som er lavere enn det som følger av myndighetsfastsatte maksimale AIP.
Det er også inngått oppgjørsavtale mellom de regionale helseforetakene og apotekene om direkte oppgjør for h-reseptlegemidlene.
Kommunefinansierte legemidler (helse- og omsorgstjenesteloven)
Kommunene har ansvar for å finansiere legemidler brukt i kommunale institusjoner, jf. Helse- og omsorgstjenesteloven § 3-2 punkt 6 og forskrift om kommunal helse- og omsorgsinstitusjon § 1. Også kommunene kjøper inn legemidler de har finansieringsansvar for gjennom anbud.
4.5.4 Pris og refusjon for medisinsk forbruksmateriell og næringsmidler
Folketrygdloven § 5-14 bestemmer at folketrygden yter stønad til dekning av utgifter til viktige legemidler og til spesielt medisinsk utstyr og forbruksmateriell. Bestemmelsen forstås slik at det også kan ytes stønad til næringsmidler i forbindelse med sykdom. Departementet har gitt nærmere regler om slik stønad i blåreseptforskriften.
Næringsmidlet og det medisinske forbruksmateriellet må være rekvirert av lege til bruk utenfor institusjon med mindre det offentlige yter stønad etter annen lovgivning jf. blåreseptforskriften § 1a. Det er et vilkår for stønad at produktene skal benyttes i forbindelse med sykdom som er gått inn i en langvarig fase, og at det er behov for langvarig bruk, jf. blåreseptforskriften § 1c.
Medisinsk forbruksmateriell
Stønad til medisinsk forbruksmateriell er nærmere regulert i blåreseptforskriften § 5. Her er det angitt 14 hjemmelspunkter hvor det fremgår hvilke hovedtyper av medisinsk forbruksmateriell det ytes stønad til og for hvilke tilstander. Ytterligere presiseringer av det enkelte punkt fremgår av rundskriv. For at det skal være rett til stønad, må brukerens tilstand være omfattet av ett av forskriftspunktene og produktet må være oppført i produkt- og prislisten for det aktuelle punktet, jf. blåreseptforskriften § 5 annet ledd. Oppfyller brukeren de kravene som stilles, kan legen rekvirere produktene på blå resept.
Leverandører av medisinsk forbruksmateriell kan søke om å få produkter forhåndsgodkjent for refusjon. Helfo kan på grunnlag av bruksverdien inndele produktene i grupper, og fastsette en egen referansepris for produkter i samme gruppe. Referanseprisen er det maksimale beløp som folketrygden kan dekke, jf. blåreseptforskriften § 5 annet ledd. Er vilkårene i blåreseptforskriften oppfylt, treffer Helfo enkeltvedtak og fører produktet opp på aktuell produkt- og prisliste.
Næringsmidler
Stønad til næringsmidler er nærmere regulert i blåreseptforskriften som angir de sykdommene hvor det kan gis stønad til næringsmidler, jf. blåreseptforskriften § 6 første ledd.
For at en lege skal kunne rekvirere næringsmidler på folketrygdens regning, må Helfo først ha truffet et vedtak som gir pasienten rett til å få dekket næringsmidlet på blå resept, jf. blåreseptforskriften § 6 annet ledd. Et slikt vedtak gis etter søknad. Etter blåreseptforskriften § 10a er det i dag kun leger som kan søke på vegne av pasienten.
Stønad ytes normalt bare til næringsmidler som fremgår av produkt- og prislister, jf. blåreseptforskriften § 6 tredje ledd. Det kan også fastsettes en egen referansepris for næringsmidler i samme gruppe. Referanseprisen er det maksimale beløp som folketrygden kan dekke.
4.5.5 Oppgjørsavtaler
Folketrygden
Folketrygdloven § 22-2 åpner for at det kan inngås avtale om direkte oppgjør mellom apotek og Helsedirektoratet eller det organ Helsedirektoratet bestemmer. I slike tilfeller blir stønaden utbetalt direkte til tjenesteyteren. Medlemmets betalingsplikt blir tilsvarende redusert. Av forskrift 15. desember 2020 nr. 2816 om direkte oppgjør for stønad etter folketrygdloven kapittel 5 gis det nærmere regler om direkte oppgjør. Av § 3 fremgår det at oppgjørskrav skal utformes i samsvar med format fastsatt av Helsedirektoratet eller det organ direktoratet bestemmer, med mindre annet er bestemt i særlovgivning. Med grunnlag i denne bestemmelsen har Helsedirektoratet utformet en standardavtale om direkte oppgjør med apotek.
Spesialisthelsetjenesten
Det er også inngått en oppgjørsavtale for h-reseptlegemidler mellom de regionale helseforetak i Norge og Apotekforeningen. Også her blir stønaden utbetalt direkte til tjenesteyteren. Det fremgår uttrykkelig av avtalen at pasientene er fritatt for egenandel på de legemidlene som omfattes av avtalen, dersom h-resept er forskrevet av gyldig rekvirent, og apoteket har ikke anledning til kreve betaling fra pasientene for disse legemidlene. Det er fastsatt en maksimal refusjonspris apotekene kan kreve fra de regionale helseforetakene, forutsatt at apoteket har fått kjøpe inn legemidlet til LIS-AIP. Maksimal refusjonspris skal ikke være lavere enn faktisk innkjøpspris tillagt maksimal apotekavanse og merverdiavgift. Det fremkommer videre av avtalen at apotek, i tillegg til maksimal apotekavanse, kan kreve oppgjør for anbrudd og istandgjøring av spesialpreparat i henhold til satser fastsatt av Legemiddelverket, samt kr. 290 eksklusive merverdiavgift for bytte til det legemidlet med lavest enhetspris innenfor byttegruppen.
4.6 Konkurranseloven
4.6.1 Konkurranselovens formål
Konkurranseloven har til formål å «fremme konkurranse for derigjennom å bidra til effektiv bruk av samfunnets interesser», jf. konkurranseloven § 1. Det følger også av bestemmelsen at det ved anvendelse av loven «særlig skal tas hensyn til forbrukernes interesser». Det er med andre ord konkurransen i et marked, og ikke konkurrentene som sådanne, som loven skal beskytte. Konkurranse kan skje langs flere parametere, blant annet pris, service, innovasjon og tilgjengelighet. I apotekmarkedet har både beliggenhet og åpningstider vært trukket frem som sentrale konkurranseparametere.
4.6.2 Konkurransetilsynet
Konkurransetilsynets oppgave er å «føre tilsynet med konkurransen i de forskjellige markeder», jf. konkurranseloven § 9. Dette gjøres særlig ved å håndheve forbudet i konkurranseloven § 10 mot konkurransebegrensende samarbeid, og forbudet mot misbruk av dominerende stilling i konkurranseloven § 11, samt føre kontroll med foretakssammenslutninger etter bestemmelsen i konkurranseloven § 16. Videre kan Konkurransetilsynet påpeke konkurranseregulerende virkninger av offentlige tiltak, eventuelt fremme forslag med sikte på å styrke konkurransen og lette adgangen for nye konkurrenter i et marked, jf. konkurranseloven § 9 bokstav e. Konkurransetilsynet fører også tilsyn på andre måter, som for eksempel ved undersøkelser av konkurransesituasjonen i bestemte markeder. Slike undersøkelser kan blant annet resultere i mistanke om brudd på konkurranselovens forbudsbestemmelser eller en påpekning med sikte på bedre konkurransen i det aktuelle markedet. I det følgende skal det redegjøres kort for de nevnte bestemmelsene. Det understrekes innledningsvis at selv om Konkurransetilsynet har til oppgave å følge med på konkurransen i markedene, bærer aktørene et selvstendig ansvar for å vurdere om deres handlinger overholder bestemmelsene i konkurranseloven.
Den norske konkurranseloven er harmonisert med EU-retten, hvilket innebærer at det norske regelverket i all hovedsak kan forstås og tolkes likt som fellesskapsrettens konkurranselovgivning. EU-kommisjonens og EU-domstolens avgjørelser er derfor sentrale rettskilder ved håndhevelse av den norske konkurranseloven.2
4.6.3 Forbudet mot konkurransebegrensende samarbeid
Det følger av konkurranseloven § 10 at «Enhver avtale mellom foretak, enhver beslutning truffet av sammenslutninger av foretak og enhver form for samordnet opptrede som har til formål eller virkning å hindre, innskrenke eller vri konkurransen, er forbudt».
Bestemmelsen innebærer i korthet at foretak ikke kan inngå konkurransebegrensende avtaler eller på andre måter samordne sin opptreden i markedet på en slik måte at konkurransen i det aktuelle markedet begrenses. «Avtale» og «samordnet opptreden» avgrenses ikke nødvendigvis innbyrdes ved håndhevelse av bestemmelsen; begrepene skal tolkes vidt og forstås i praksis som enhver adferd mellom foretak som erstatter usikkerheten som følger av reell konkurranse, med en form for felles vilje om å innrette seg på en måte som begrenser konkurransen. Grensen går mot ensidige handlinger, altså handlinger der et foretak ensidig tilpasser seg konkurrentene i markedet uten at det ligger noen felles vilje eller avtale til grunn for adferden.
Forbudet retter seg også mot «sammenslutninger av foretak». Dette omfatter typisk bransjeforeninger eller lignende. Apotekforeningen og Farma Norge er eksempler på sammenslutninger av foretak i konkurranselovens forstand, og de må derfor påse at de aktiviteter som skjer innad i foreningen, ikke legger til rette for eller på andre måter fasiliterer en begrensning av konkurransen mellom dens medlemmer.
Det norske apotekmarkedet domineres av tre vertikalt integrerte kjeder og utgjør dermed et oligopol. I slike oligopolistiske markeder ligger gjerne forholdene til rette for at aktørene tilpasser seg hverandre, med begrenset konkurranse som resultat. Det er derfor særlig viktig at apotekkjedene påser at deres adferd overholder de grensene som konkurranseloven § 10 oppstiller. Det kan for eksempel utgjøre en misbrukshandling dersom kjedene har jevnlige møter der konkurransesensitiv informasjon utveksles.
Det er imidlertid ikke slik at ethvert samarbeid mellom konkurrenter er forbudt. For at konkurranseloven § 10 skal komme til anvendelse, må samarbeidet enten ha til formål eller virkning å begrense konkurransen mellom foretakene.
Dersom det mellom konkurrenter inngås et samarbeid hvis formål er å begrense konkurransen, foreligger det i utgangspunktet brudd på bestemmelsen uavhengig av om samarbeidet faktisk har hatt konkurransebegrensende virkninger. I slike saker trenger konkurransemyndigheten derfor ikke bevise at konkurransen faktisk har blitt eller blir begrenset som følge av adferden. Avtaler som per se har til formål å begrense konkurransen, er for eksempel avtaler om priser og markedsdeling.3
En avtale som ikke kan anses å ha til formål å begrense konkurransen, men likevel har en slik virkning, kan også være forbudt etter konkurranseloven § 10. I slike saker må konkurransemyndighetene kunne vise at den aktuelle adferden virker konkurransebegrensende i det aktuelle markedet. En slik virkningsanalyse skjer konkret og innebærer som regel en kompleks analyse av den aktuelle adferden.
Forbudet i konkurranseloven gjelder ikke bare den konkurransen som faktisk finner sted i markedet, men også begrensning av potensiell konkurranse. Samarbeid som går ut på å utestenge potensielle konkurrenter eller på andre måter hindre potensielle aktørers tilgang til markedet, kan derfor også være forbudt etter konkurranseloven § 10.
Adferd som er forbudt etter konkurranseloven § 10 første ledd, kan likevel være lovlig dersom man etter en vurdering av vilkårene i bestemmelsens tredje ledd kommer til at de negative virkningene av avtalen oppveies av effektivtetsgevinster. Det er de aktuelle foretakene som har bevisbyrden for at slike effektivtetsgevinster foreligger.
Brudd på konkurranseloven § 10 kan sanksjoneres med overtredelsesgebyr, jf. konkurranseloven § 29.4
4.6.4 Forbudet mot misbruk av dominerende stilling
Det følger av konkurranseloven § 11 første ledd at også «et eller flere foretaks utnyttelse av sin dominerende stilling» er forbudt.
Hvorvidt et foretak har en slik dominerende stilling som loven krever, må avgjøres konkret i den enkelte sak. Det sentrale vurderingskriteriet er om foretaket er i en posisjon der det i betydelig grad kan opptre uavhengig av sine kunder og konkurrenter. Det følger av dette at det for å kunne konstateres dominerende stilling først må avgrenses et relevant marked. Når det er fastslått hvilket marked saken gjelder, kan det aktuelle foretakets stilling i markedet vurderes, altså om det er å anse som dominerende eller ikke. Det følger imidlertid av rettspraksis at en markedsandel på 50 prosent eller mer gir en presumpsjon for dominans, med mindre det foreligger særskilte omstendigheter.5
Et relevant marked består både av et produktmarked og et geografisk marked. Produktmarkedet defineres ut fra hvilke produkter som er innbyrdes substituerbare, gjerne omtalt som de produkter kundene vil bytte til dersom det for det aktuelle produktet foretas en liten, men varig prisøkning på fem til ti prosent. Dersom et tilstrekkelig antall kunder vil bytte til et annet produkt og prisøkningen derfor ikke vil være lønnsom, innlemmes det/de aktuelle produktene i det relevante produktmarkedet. I vurderingen er det også relevant om et annet foretak reagerer på prisøkningen ved å omstille sin produksjon og slik gå inn som en konkurrent til det aktuelle foretaket. En slik omstilling må kunne skje raskt og være lønnsom dersom den skal inngå i definisjonen av produktmarkedet. På tilsvarende måte må det avgrenses et geografisk marked der det avgjørende er i hvilken grad kunden er villig til å bytte til en leverandør i et annet område dersom prisen på det aktuelle produktet øker hos nåværende leverandør. Den geografiske avgrensningen beror ofte på hvor i distribusjonsleddet man befinner seg. En sluttbruker i apotekmarkedet vil for eksempel neppe reise betydelig lenger ved en prisøkning som nevnt over, hvilket tilsier at den geografiske avgrensningen av markedet i en slik anledning trolig vil bli lokal. På den annen side kan apotekkjedene i sine forhandlinger med ulike leverandører velge mellom flere internasjonale aktører, hvilket innebærer en mer internasjonal avgrensning av markedet.
Det følger av ordlyden at to eller flere foretak sammen kan ha kollektiv dominans. Dette betyr i praksis at foretakene opptrer som en enhet, og at de kan gjøre det på samme måte som et dominerende foretak, altså uavhengig av andre aktører i markedet. Dette kan særlig være aktuelt i oligopolmarkeder. Selv om det ikke foreligger et samarbeid, kan aktørene i slike markeder etablere en parallell adferd som ligger i grenselandet mellom samordnet opptreden og ensidig adferd.
Det er i seg selv ikke ulovlig å ha en dominerende stilling. Det er heller ikke ulovlig å vokse ved å konkurrere hardt, så lenge dette skjer på grunnlag av ytelser, som pris, utvalg, kvalitet og innovasjon – ofte kalt «competition on the merits». Hvis et foretak først har en slik stilling, innebærer det imidlertid et særlig ansvar for å påse at egen opptreden ikke begrenser konkurransen i markedet. I dette ligger at adferd som lovlig kan foretas av andre, ikke-dominerende foretak, kan være utilbørlig utnyttelse av markedsmarkedsmakt for et dominerende foretak.
Hva som utgjør en slik utilbørlig utnyttelse av en dominerende stilling, må vurderes konkret. Det følger av rettspraksis at det sentrale vurderingskriteriet er om den aktuelle handlingen er konkurranseskadelig. Typisk adferd som kan utgjøre misbrukshandlinger, er inngåelse av eksklusivavtaler, forretningsnektelser, koblingsavtaler, overprising, lojalitetsrabatter og predasjonsprising. Adferd som i utgangspunktet faller inn under forbudet i konkurranseloven § 11, kan likevel være lovlige dersom foretaket kan godtgjøre at den var objektiv nødvendig eller at den kan oppveies av effektivitetsgevinster som også kommer forbrukerne til gode.
Som ved overtredelse av konkurranseloven § 10, kan overtredelse av konkurranseloven § 11 sanksjoneres med overtredelsesgebyr etter konkurranseloven § 29.6
4.6.5 Fusjonskontrollen
Strukturkontrollen i konkurranseloven følger av bestemmelsene i konkurranseloven § 16 følgende. Det følger av konkurranseloven § 16 at Konkurransetilsynet skal forby foretakssammenslutninger som i betydelig grad vil hindre effektiv konkurranse, særlig som et resultat av at en dominerende stilling skapes eller styrkes. Det er kun foretak med en omsetning over visse terskelverdier som har meldeplikt til Konkurransetilsynet, jf. konkurranseloven § 18 første og annet ledd. Konkurransetilsynet kan imidlertid på eget initiativ pålegge meldeplikt for foretakssammenslutninger dersom det finner rimelig grunn til å anta at konkurransen påvirkes eller dersom særlige hensyn tilsier at Konkurransetilsynet undersøker foretakssammenslutningen nærmere, jf. konkurranseloven § 18 tredje ledd.
4.6.6 Påpekningsadgangen
Konkurransetilsynet kan som nevnt innledningsvis påpeke forhold ved offentlig regulering som tilsynet finner at kan virke uheldig på konkurransesituasjonen, jf. konkurranseloven § 9.
Konkurransetilsynet har ved et par anledninger benyttet påpekningsadgangen overfor norske helsemyndigheter. I brev 19. august 2019 til Helse- og omsorgsdepartementet anmodet Konkurransetilsynet om at den dagjeldende bestemmelsen i apotekforskriften § 13 ble fjernet. Det var Konkurransetilsynets vurdering at bestemmelsen som satte markedsandelstak for apotek på 40 prosent, kunne virke konkurransebegrensende i markedet. Bestemmelsen ble senere opphevet, se kapittel 4.4.2.
4.6.7 Høringer
I tillegg til nevnte lovbestemmelser er Konkurransetilsynet ofte høringsinstans ved forslag til lovendringer, herunder lovendringer i apotekmarkedet. En viktig del av det å føre tilsyn med konkurransen er å vurdere forslag til lovendringer med tanke på forslagets virkning på konkurransen i det aktuelle markedet.
Konkurransetilsynet har inngitt merknader til flere slike høringer. Fra den senere tid nevnes merknader til høring om endringer i trinnprismodellen7, høring om forslag til endring i apotekloven § 6-6 om endringer i bytteordningen for legemidler8, høring om gjennomføring av forordning (EU) 2019/933 om endring av forordning (EU) nr. 469/20099, høring om endringer i LUA-ordningen10, og kommentar på forslag om restriksjoner som følge av mulig mangelsituasjon11. Når det gjelder forslag om utvidelse av LUA-ordningen, har Konkurransetilsynet vært fast høringsinstans. Fordi Konkurransetilsynet i utgangspunktet ser positivt på alle forslag til endringer som innebærer økt konkurranse på legemidler, har Konkurransetilsynet alltid støttet slike forslag til utvidelse. Ved at flere legemidler omsettes i LUA-ordningen, øker sannsynligheten for konkurranse på disse produktene, herunder både konkurranse på pris og tilgjengelighet.
4.6.8 Konkurransetilsynets arbeid
Apotekmarkedet har lenge vært et prioritert marked for Konkurransetilsynet. Med sine særskilte karakteristika i form av tre vertikale kjeder med betydelig omsetning, prisregulering og til dels tredjepartsfinansiering er det Konkurransetilsynets vurdering at det er viktig å følge særlig med på konkurransesituasjonen i dette markedet.
I rapporten Konkurransen i Norge som Konkurransetilsynet utga 1. januar 2009, var legemiddel- og apotekmarkedet et av de markedene som ble særskilt omtalt. I rapporten foreslo Konkurransetilsynet blant annet å oppheve fullsortimenskravet for grossister, tillate e-handel og utvide LUA-ordningen. Forslagene har senere blitt fulgt opp i praksis. Konkurransetilsynet deltar videre i Europakommisjonens nettverksgruppe for legemiddelmarkedet (ECN Pharma) der relevante saker innen legemiddel- og apotekmarkedet redegjøres for og diskuteres. Konkurransetilsynet samarbeider også tett med de andre nordiske landenes konkurransemyndigheter på dette feltet, senest med rapporten «Online Pharmacy Markets in the Nordics».
Fotnoter
Antall per 31. desember 2001, kan avvike fra antall senere i rapporten, da disse refererer til antall apotek per 1. januar.
Relevante saker i legemiddelmarkedet er Case AT. 40394-Aspen, EU-domstolens sak C-457/10 P og sak C-179/16.
Jf. konkurranseloven § 10 første ledd bokstav a. Opplistingen kan ikke anses som uttømmende, men gir en oversikt over avtaler som typisk kan ha et konkurransebegrensende formål.
Kommisjonen påla i 2020 et gebyr på € 60,5 millioner for pay for delay i sak AT 39686-CEPHALON for brudd på tilsvarende bestemmelse i EU-traktaten artikkel 101.
Jf. sak 85/76, Hoffmann-La Roche mot Kommisjonen, avsnitt 41; sak T-65/98, Van den Bergh Foods mot Kommisjonen, avsnitt 154; sak C-62/86, AKZO Chemie mot Kommisjonen, avsnitt 60; sak T-340/03, France
Se Kommisjonens sak Case COMP/A 37.507/F3 – AstraZeneca.
Konkurransetilsynets sak 2021/0427.
Konkurransetilsynets sak 2020/0255.
Konkurransetilsynets sak 2019/0465.
Konkurransetilsynets sak 2019/0469.
Konkurransetilsynets sak 2019/0393.